Медицински експерт на статията
Нови публикации
Хипофизна анемия (джудже)
Последно прегледани: 12.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Терминът „хипофизен нанизъм“ (от гръцки nanos - джудже; син.: нанизъм, наносомия, микрозомия) в абсолютен смисъл означава заболяване, чиято основна проява е рязко забавяне в растежа, свързано с нарушение на секрецията на растежен хормон от предната хипофизна жлеза.
В по-широк смисъл, нанизмът е нарушение на растежа и физическото развитие, чието възникване може да бъде причинено не само от абсолютен или относителен дефицит на соматотропен хормон, дължащ се на патология на самата хипофизна жлеза, но и от нарушение на хипоталамичната (церебрална) регулация на нейните функции, дефекти в биосинтеза на соматотропен хормон и нарушения на тъканната чувствителност към този хормон.
Причини джуджета
Повечето форми на хипофизен нанизъм са генетични заболявания. Най-често срещаният е панхипопитуитарният нанизъм, който се унаследява предимно по рецесивен начин. Предполага се, че има 2 вида предаване на тази форма на патология - автозомно и чрез Х хромозомата. При тази форма на нанизъм, наред с дефекта в секрецията на соматотропин хормон, най-често се нарушава секрецията на гонадотропини и тиреостимулиращ хормон. Секрецията на ACTH се нарушава по-рядко и в по-малка степен. Функционални изследвания с освобождаващи хормони, включително синтетичен соматотропин-освобождаващ хормон (състоящ се от 29, 40 и 44 аминокиселинни остатъка), подобен на панкреатичния полипептид, показват, че повечето от тези пациенти имат патология на ниво хипоталамус, а недостатъчността на предната хипофизна жлеза е вторична. Първичната патология на самата хипофизна жлеза е по-рядко срещана.
Генетичният нанизъм с изолиран дефицит на растежен хормон, с нарушена биологична активност и чувствителност към него, се среща спорадично в Русия и съседните страни. По-често срещан е на американския континент, в страните от Близкия и Средния изток и в Африка. Въз основа на резултатите от изследване на кръвното съдържание на соматотропен хормон и чувствителността на пациентите към екзогенен соматотропен хормон, нивото на имунореактивен инсулин (IRI), инсулиноподобни растежни фактори (IGF) тип I (соматомедин C) и тип II, както и отговора на IGF-1 на лечение със соматотропни хормонални препарати, са идентифицирани различни варианти на клинично подобни типове нанизъм.
Наскоро беше дешифрирана патогенезата на джуджестия нанизъм на Ларон, причинен от дефицит на IRF-1 и IRF-II, както и патогенезата на джуджестия нанизъм при африканските пигмеи, свързана с дефицит на първия.
През 1984 г. е описан нов вариант на псевдохипофизен нанизъм с високо ниво на соматотропен хормон и IGF-1; генезисът на нанизма се обяснява с дефект в неговите рецептори, което се доказва от рязко намаляване на свързването на кожните фибробласти с IGF-1.
Трябва да се подчертае, че в съвременните условия, с наличието на малки семейства, много изолирани („идиопатични“, спорадични) случаи на заболяването могат да бъдат и генетични.
При анализа на 350 истории на заболяването, етиологията на джуджето е била неясна при 228 пациенти (65,2%). Тази група включва пациенти от 57 семейства с повтаряща се поява на джуджето (2-4 случая на семейство), което представлява 28% от всички пациенти. В 77% от семействата с етиологично неясни (предимно генетични) форми на джуджето е установена неоспорима връзка с наследяването на липсата на Rh фактор. Разпределението на Rh фактора в семействата на пациенти с джуджето се различава от наблюдаваното при Rh конфликт между майката и плода и като правило не е съпроводено с хемолитична болест на новороденото (бащата може да е Rh отрицателен, а в случай на хетерозиготност на родителите за Rh фактора - децата и др.). Възможно е да се предположи връзка между активността на гените, отговорни за синтеза на соматотропен хормон (или соматотропин-освобождаващ хормон), и гените, определящи Rh фактора, особено след като повечето форми на джуджето и липсата на Rh фактор са автозомно-рецесивни черти. Това не обяснява относителната рядкост на джуджестия нанизъм в сравнение с честотата на Rh-отрицателните индивиди в популацията. Вероятно някои все още неизвестни допълнителни фактори са важни, но характеристиките на разпределението на Rh фактора в семействата на пациенти с фамилен и спорадичен джуджест нанизъм е малко вероятно да са случайни.
Голяма група пациенти с нанизъм (първичен церебрален, церебрално-хипофизен) са пациенти с различни видове органична патология на централната нервна система, възникнала вътреутробно или в ранна детска възраст. Анатомичният субстрат, който причинява тази патология, може да бъде недоразвитие или липса на хипофизната жлеза, нейната дистопия при патология на образуването на турското седло, кистозна дегенерация на хипофизната жлеза, нейната атрофия поради компресия от тумор (краниофарингиом, хромофобен аденом, менингиом, глиом). Джуджето може да бъде причинено от травматични увреждания на хипоталамо-хипофизната област (вътрематочни, родови или постнатални), което често се среща при многоплодна бременност, както и по време на раждане в седалищно предлежание, на стъпало или в напречно положение с ротация на крака (това е механизмът на раждане при повече от 1/3 от пациентите с нанизъм). Инфекциозните и токсичните увреждания са от значение (вътрематочни вирусни инфекции, туберкулоза, сифилис, малария, токсоплазмоза; заболявания в ранна възраст, неонатален сепсис, менинго- и арахноенцефалит и др.). Тези процеси могат да увредят самата хипофизна жлеза, хипоталамичните центрове, които регулират нейната функция, и да нарушат нормалните функционални връзки в централната нервна система.
Вътрематочните фетални лезии могат да доведат до раждане на пациенти с „джудже по рождение“ с нормална секреция на растежен хормон (церебрален примордиален нанизъм, микроцефалия, Силвър-Ръселов нанизъм с телесна хемиасиметрия и високи нива на гонадотропини и др.).
Допълнителни фактори, които влошават нарушението на физическото развитие при нанизъм, могат да бъдат неадекватно хранене, небалансирано по отношение на основни съставки (дефицит на протеини) и микроелементи (дефицит на цинк), и неблагоприятни условия на околната среда, както и различни хронични заболявания, като гломерулонефрит, при който азотемията засяга активността на чернодробните рецептори или директно влияе върху метаболизма на чернодробните клетки, причинявайки намаляване на синтеза на соматомедин, или цироза на черния дроб, когато образуването на соматомедин е нарушено.
Патогенеза
При повечето пациенти с хипофизен нанизъм промените не се ограничават до патология на секрецията на соматотропен хормон и чувствителност към него, а се простират и до други тропни хормони на хипофизната жлеза, което причинява различни комбинации от ендокринни и метаболитни нарушения.
При изолиран дефицит на соматотропен хормон, морфологичните промени в хипофизната жлеза са слабо проучени. В изследваните случаи рядко са открити патологични нарушения (краниофарингиом или хиперостоза на черепните кости). При този тип нанизъм може да се наблюдава вродено недоразвитие на пептидергичните клетки или дефект в невротрансмитерната система в хипоталамуса. В такива случаи нанизмът може да се комбинира с дисплазия или хипоплазия на зрителните нерви. Интраселарните кисти, туморите на хипофизата и хипоталамуса водят до дефицит на STH, причинявайки компресия на хипофизната тъкан, по-специално на соматотрофите.
Джуджетовидният растеж се характеризира с изтъняване на костите, главно поради кортикалния слой, забавена диференциация и осификация на скелета. Вътрешните органи са хипопластични, понякога атрофични, а мускулите са слабо развити.
Симптоми джуджета
Рязкото изоставане в растежа и физическото развитие са основните прояви на хипофизния нанизъм. Пациентите се раждат с нормално телесно тегло и дължина и започват да изостават в растежа от 2-4-годишна възраст.
Преди появата на активното лечение на нанизма, за джуджета се считаха тези с ръст под 120 см за жените и 130 см за мъжете. В момента ръстът на джуджето се различава с поне 2-3 сигма отклонения от средната таблична норма за даден пол, възраст или популация. Съществува и метод за графична оценка на ръста, базиран на Гаусовата крива на разпределение. В този случай джуджетата по ръст се включват в група, която включва минималния брой индивиди в съответната популация с най-голямо изоставане от средната норма на растеж.
Хипофизният нанизъм се характеризира не само с малък абсолютен телесен размер, но и с малка годишна динамика на растеж и физическо развитие. Телесното телосложение е пропорционално, но пропорциите на тялото на пациентите са типични за детска възраст. Кожата е бледа, често с жълтеникав оттенък, суха, което се дължи на абсолютна или относителна тиреоидна недостатъчност, понякога се наблюдава цианоза - "мрамориране" на кожата. При нелекувани пациенти рано се появява състаряваща и набръчкана кожа (геродермия). Това се дължи на недостатъчността на анаболното действие на STH и бавната смяна на клетъчните поколения.
Косата на главата може да бъде нормална или суха, тънка, чуплива; типични са дълги мигли. Вторичният растеж на косата често липсва. Размерът на турското седло при повечето пациенти с нанизъм (70-75%) не се променя, но седлото често запазва детската форма на „изправен овал“, има широк „ювенилен“ гръб, синусът на клиновидната кост изостава по отношение на пневматизация. Има обаче пациенти с уголемена турска седло, което е признак на тумор; с области на калцификация на фона или в областта на входа (с краниофарингиом, остатъчни ефекти от невроинфекция) или нейното намаляване (признаци на недоразвитие, малък размер на хипофизната жлеза). Наблюдават се симптоми на вътречерепна хипертония: изтъняване на костите на черепния свод, засилен съдов модел, наличие на пръстови отпечатъци и др. Най-важният признак на хипофизен нанизъм е забавяне във времето на диференциация и осификация на скелета. Характеристиките на зъбочелюстната система също са тясно свързани със скелетната диференциация: отбелязва се късно заместване на млечните зъби. Най-голямо забавяне в развитието на скелетната система се наблюдава при пациенти с нанизъм със сексуална недостатъчност и хипотиреоидизъм.
Гениталиите на повечето пациенти са силно недоразвити, въпреки че малформациите са рядкост. Наблюдавахме крипторхизъм при 5,8% от мъжете пациенти. Сексуалната недостатъчност е съпроводена с недоразвитие на вторичните полови белези и намалено сексуално желание, липса на менструация. Нормално спонтанно полово развитие се наблюдава само при пациенти с изолиран дефицит на растежен хормон и при някои пациенти с церебрален нанизъм.
Тиреоидната недостатъчност е доста често срещан симптом на нанизъм. Трябва да се отбележи, че външните прояви на хипотиреоидизъм не винаги отразяват истинското функционално състояние на щитовидната жлеза. Това се дължи на относителния хипотиреоидизъм, дължащ се на нарушение на прехода на тироксин (Т4 ) към трийодотиронин (Т3 ) и образуването на неактивен (обратим) Т3 , което е характерно за соматотропната недостатъчност.
Адренокортикотропната функция при хипофизен нанизъм намалява по-рядко и в по-малка степен от половите и тироид-стимулиращите функции и при повечето пациенти не изисква специална корекция.
В повечето случаи интелектът не е нарушен. Срещат се емоционални промени под формата на психичен инфантилизъм; при по-възрастни пациенти без интелектуални нарушения понякога се наблюдават реактивни неврози.
При органична мозъчна патология, особено с туморен характер, може да се наблюдава нанизъм със симптоми на безвкусен диабет, битемпорална хемианопсия и интелектуални затруднения.
Проучването на развитието на биоелектричната активност на мозъка при пациенти без органични симптоми на централната нервна система показа, че тяхната ЕЕГ се характеризира с признаци на незрялост, дългосрочно запазване на високо „детско“ ЕЕГ напрежение; неравномерност на алфа ритъма по амплитуда и честота; рязко увеличение на съдържанието на бавни θ- и δ-ритмове, особено във фронталните и централните отвеждания; ясна реакция на хипервентилация; изместване на диапазона на ЕЕГ ритмите, следвайки ритмите на светлинна стимулация към ниски честоти (доказателство за намаляване на функционалната мобилност на нервните структури на мозъка). Беше разкрито, че при по-възрастните пациенти незрелият характер на електрическата активност на мозъка се дължи на полова недоразвитост, а при пациенти от всички възрастови групи - хипотиреоидизъм.
Въглехидратният метаболизъм при пациенти с нанизъм се характеризира с тенденция към намаляване на нивата на кръвната захар на гладно, повишаване по време на физическо натоварване, недостатъчност на ендогенен инсулин, повишена чувствителност към екзогенен инсулин с често развитие на хипогликемични състояния. Последното се обяснява главно с недостатъчни нива на контраинсуларни хормони в организма на пациентите.
Вътрешните органи показват спланхномикрия, т.е. намаляване на размера им. Не са описани функционални промени във вътрешните органи, специфични за нанизма. Често се наблюдава артериална хипотония с намалено систолично и диастолично налягане и намалена амплитуда на пулса. Сърдечните звуци са приглушени, чуват се функционални шумове от различна тематика, дължащи се на трофични промени в миокарда и вегетативни нарушения. ЕКГ се характеризира с ниско напрежение (особено при наличие на хипотиреоидизъм), синусова брадикардия или брадиаритмия; ФКГ показва намаляване на амплитудата на тоновете, допълнителни тонове и функционални шумове. Данните от оксигемометрията показват хипоксемия (начална и по време на физическо натоварване) и кислороден дълг. Пациентите в напреднала възраст понякога развиват хипертония.
Диагностика джуджета
Диагнозата и диференциалната диагноза на нанизма се основават на анамнезни данни и цялостно клинично, рентгенологично, лабораторно и хормонално изследване. В допълнение към абсолютния размер на тялото, за оценка на растежа на пациентите се определя дефицит на растеж - разликата между ръста на пациента и средната му норма за съответния пол и възраст; възраст на растежа - съответствие на ръста на пациента с определени стандарти; индикатор за нормализирано отклонение
I = M - Mcp / δ, където M е ръстът на пациента, Mcp е средният нормален ръст за даден пол и възраст, δ е квадратичното отклонение от Mcp; I по-малко от 3 е типично за нанизъм, I повече от 3 е типично за гигантизъм. Този показател може да се използва за оценка на динамиката на развитието.
Рентгеновото изследване на пациенти с нанизъм разкрива признаци на вътречерепна хипертония, остатъчни ефекти от невроинфекция, калцификати и краниосиностоза. Изследването на размера, формата и структурата на турското седло се счита за косвен индикатор, характеризиращ размера на хипофизната жлеза. Една от най-важните прояви на патологично забавяне на растежа е нарушението на скелетната диференциация. За да се оцени степента на скелетна зрялост, се определя костната (рентгенографска) възраст, която съответства на диференциацията на костната тъкан; дефицитът на осификация е степента на изоставане на осификацията от нормата (в години), коефициентът на осификация е частното на разделяне на костната възраст на хронологични и други параметри.
Съвременната диагностика на нанизма е невъзможна без изучаване на секрецията на соматотропен хормон, неговото базално ниво, циркаден ритъм и освобождаване при стимулация. Повечето пациенти с хипофизен нанизъм се характеризират с намалено съдържание на соматотропен хормон в кръвния серум. При определяне чрез радиоимунологичен метод, то е (според различни автори) от (0,87±0,09) до (1,50±0,64) ng/ml, със средна норма от (3,81±0,29) ng/ml. Проучване на дневните (циркадни) ритми на секрецията на соматотропен хормон показа, че нивото му при здрави хора е максимално през първите 2 часа на съня и в 4-6 часа сутринта. При нанизма съдържанието на соматотропен хормон също е намалено през тези часове.
За изследване на резервите на соматотропната функция се използват различни стимуланти, като се изследва съдържанието на соматотропен хормон преди и след тяхното приложение. Кръв за изследването се взема на всеки 30 минути в продължение на 2-3 часа. Освобождаването на соматотропен хормон след стимулация се счита за нормално поне до 7-10 ng/ml, понякога достига 20-40 ng/ml. Ако няма реакция в една от пробите, се провеждат повторни изследвания с други стимуланти. Недостатъчност на соматотропен хормон се счита за доказана при липса на освобождаване на соматотропен хормон в 2-3 различни проби.
Най-често използваните стимулиращи тестове са: с интравенозно приложение на 0,1 U (0,75-1,5 U) инсулин на 1 kg телесно тегло на пациента и постигане на хипогликемия (намаление на нивото на кръвната захар с 50% в сравнение с началното ниво), серумният соматотропен хормон се определя по горната схема. Ако се развие тежка хипогликемия, тестът се прекъсва и на пациента се прилага глюкоза интравенозно. Това е най-разпространеният, класически диагностичен метод.
ТРХ в доза от 200-500 мкг интравенозно. Ефективно идентифицира хормоналните резерви, не причинява усложнения. В комбинация с инсулиновия тест позволява да се прецени нивото на увреждане на хипоталамо-хипофизната система. Положителната реакция към ТРХ при липса на такава към инсулинова хипогликемия показва непокътнатост на хипофизната жлеза и увреждане на хипоталамусно ниво, отрицателните реакции към ТРХ и хипогликемията показват увреждане на самата хипофизна жлеза.
TRH, LH-RH в доза от 300 mcg интравенозно е подобно на предишното.
Човешкият SGH е синтетичен аналог на биологично активно съединение, изолирано от тумор на панкреаса. В момента съществуват 3 вида синтетичен SGH: с 29, 40 и 44 аминокиселинни остатъка. Използва се интравенозно в дози от 1 до 3 μg/kg телесно тегло на пациента. Освобождаването на STH се наблюдава 15-20 минути след приложението, тестът е по-ефективен от другите при разкриване на резерви от ендогенен растежен хормон. Положителната SGH реакция показва хипоталамично ниво на увреждане на соматотропната функция и непокътната хипофизна жлеза; с аминокиселини (L-аргинин монохлорид, орнитин, триптофан, глицин, левцин) интравенозно в доза 0,25-0,5 g на 1 kg телесно тегло на пациента. Ефективен за изследване на резервите на SGH. Може да причини алергични реакции.
L-допа перорално в доза 250-500 мкг. Ефективен, добре поносим от пациентите.
Използват се също тестове с глюкагон, бром ергокриптин (парлодел), лизин вазопресин, клонидин и дозирано велоергометрично натоварване.
Изследването на състоянието на соматотропната функция е необходимо не само за диагностицирането на нанизъм, но и за обоснования избор на метод на терапия, тъй като лечението със соматотропин е рационално само в случай на недостатъчност на ендогенен растежен хормон.
За диагностицирането на формата на нанизъм е много важно да се изследва съдържанието на инсулиноподобни растежни фактори или соматомедини (особено IGF-1, или соматомедин C) - медиатори на действието на соматотропния хормон на тъканно ниво. Известно е, че съдържанието на соматомедин C при нанизъм е намалено, а при акромегалия - повишено в сравнение с нормата. Формата на нанизъм, описана от Ларон, е вид заболяване с нормално производство на STH, но с нарушение на образуването на IGF-1 и IGF-II. Лечението на такива пациенти със соматотропин е безсмислено.
Косвени показатели за соматотропната функция на хипофизната жлеза са активността на алкалната фосфатаза и съдържанието на неорганичен фосфор в серума. При хипосоматотропни състояния тези показатели са намалени. При панхипопитуитарната форма на нанизъм секрецията на гонадотропини, често TSH, е намалена, което е съпроводено със съответно намаляване на функциите на половите жлези (дефицит на андрогени или естрогени), щитовидната жлеза (намаляване на нивата на Т3 , Т4 , протеин-свързан йод - PBI, натрупване на 131I от щитовидната жлеза) и надбъбречните жлези (намаляване на количеството кортизол и 17-OCS в плазмата, екскреция на 17-KC и 17-OCS в урината, лимфоцитоза).
Всички видове хипофизен (хипоталамо-хипофизен) генетичен нанизъм се характеризират с многократно заболяване на деца в семейство с унаследяване по автозомно-рецесивен (по-често) или автозомно-доминантен тип, забавяне на растежа и физическото развитие от 2-4 години с изоставане от поне 2-3 o от средните норми на растеж за даден пол, възраст, популация, с ниска спонтанна годишна динамика на растеж, забавена осификация. При ниско ниво на соматотропен хормон (в 2-3 стимулиращи теста под 7 ng/ml), терапията със соматотропен хормон е високоефективна (дава увеличение на височината от поне 7 см годишно). При нормално или високо ниво на соматотропен хормон (с неговата биологична неактивност), чувствителността към хормона може да се запази. Не се наблюдават промени в интелигентността.
При генетичен нанизъм с тъканна нечувствителност към соматотропен хормон, клиничната картина е подобна на изолиран дефицит на растежен хормон, но терапията със соматотропин е неефективна. В тази група могат да се разграничат следните основни форми според нивото на IRF: с нормално съдържание (дефект на IRF рецептора) и намалено - нанизъм тип Ларон (дефицит на IRF-1 и IRF-II) и типът, срещан при африканските пигмеи (дефицит на IRF-1).
Церебралният нанизъм се характеризира с изолирани заболявания в семейство, свързани с вътрематочно или постнатално увреждане на централната нервна система, с наличието на очевидни органични промени в централната нервна система, често комбинирани с патология на зрителния орган, наличие на безвкусен диабет, запазване на гонадотропните функции и промени в интелигентността.
Някои видове гонадна дисгенеза и агенеза са съпроводени с изразен нисък ръст, по-специално синдромът на Шерешевски-Търнър и "Търнероидната" (мозаична) форма на синдрома на тестикуларна дисгенеза. Цитогенетичните изследвания (полов хроматин, кариотип) помагат в диференциалната диагноза, разкривайки хромозомни дефекти, както и характерни дефекти на соматичното и половото развитие, нормални или повишени нива на ендогенен соматотропен хормон и нечувствителност към лечение със соматотропин.
Сред ендокринните нарушения, протичащи с нисък ръст, трябва да се открои първичният хипотиреоидизъм, причинен от вродена хипоплазия или аплазия на щитовидната жлеза, нейната дистопия, ензимни дефекти в биосинтеза на тиреоидни хормони, ранно автоимунно увреждане на щитовидната жлеза. При всички тези състояния доминират признаци на хипотиреоидизъм с високо ниво на TSH, намаляване на T4 и T3 в кръвния серум. При микседем с автоимунен генезис в кръвта се откриват антитела към тиреоглобулин, микрозомни и ядрени фракции на тиреоидната тъкан, нивото на соматотропен хормон е нормално или намалено. Клиничният ефект може да се постигне чрез компенсиране само на хипотиреоидизма.
Ниският ръст е съпроводен с преждевременно полово развитие и адреногенитален синдром поради ранно затваряне на зоните на растеж; болестта на Иценко-Кушинг, която се проявява в детска възраст поради инхибиторния ефект на глюкокортикоидите върху секрецията на соматотропен хормон и техния катаболен ефект; синдром на Мориак - нисък ръст и инфантилизъм при пациенти с тежък инсулинозависим захарен диабет.
Хипофизният нанизъм трябва да се диференцира от соматогенно забавяне на физическото развитие, причинено от хронични метаболитни нарушения (при заболявания на черния дроб, бъбреците, стомашно-чревния тракт), хронична хипоксия (при заболявания на сърдечно-съдовата и дихателната системи, при анемия); със системни заболявания на опорно-двигателния апарат (хондродистрофия, несъвършена остеогенеза, екзостозна болест) и др.
Функционално (конституционално) забавяне на растежа понякога се наблюдава с късно начало на пубертета при наглед здрави юноши; установихме, че то е свързано предимно с преходна недостатъчност на гонадотропната активност. Секрецията на соматотропен хормон обикновено не е нарушена или е леко намалена. Стимулирането на гонадотропини може да ускори както половото развитие, така и растежа.
Ниският ръст от семеен характер трябва да се разглежда като вариант на физиологично развитие.
Какво трябва да проучим?
Как да проучим?
Какви тестове са необходими?
Към кого да се свържете?
Лечение джуджета
Лечението на нанизма е дълъг процес. Това принуждава лекаря да разпредели средствата за повлияване на растежа във времето, за да се постигне най-голям клиничен ефект, като същевременно се спазват 2 основни принципа:
- максимално приближаване на индуцираното от лечението развитие до физиологичните условия;
- щадейки епифизарните зони на растеж.
Дългогодишният опит в лечението на нанизъм ни позволява да считаме следната схема на етапна терапия за подходяща. Диагнозата нанизъм при възрастни пациенти обикновено не поражда съмнения. При малки деца, ако клиничната картина е неясна, е необходим диагностичен период: 6-12 месеца под наблюдение без хормонална терапия. През това време се предписва комплексно общоукрепващо лечение; адекватно хранене с увеличаване на съдържанието на животински протеини, зеленчуци и плодове в диетата, витамини А и D, калциеви и фосфорни препарати. Липсата на достатъчни промени в растежа и физическото развитие на този фон и откриването на ендокринни нарушения по време на прегледа са основа за започване на хормонална терапия.
Основният вид патогенетична терапия за хипофизния нанизъм е използването на човешки растежен хормон, тъй като появата на повечето случаи на нанизъм несъмнено зависи от една или друга форма на неговия дефицит. Поради видовата специфичност на този хормон, само човешкият и приматният соматотропин е активен за хората. Лекарство, изолирано от хипофизната жлеза на хора, починали от неинфекциозни и нетуморни заболявания, се използва широко в клиниката. Човешкият соматотропин се получава чрез бактериален синтез с помощта на Escherichia coli чрез генно инженерство. Човешкият соматотропин също се синтезира химически, но е изключително скъп и практически не се използва в клиниката. Пациенти с доказан дефицит на ендогенен растежен хормон, с скелетна диференциация, ненадвишаваща нивото, типично за 13-14-годишна възраст, се подбират за лечение със соматотропин. Няма възрастови ограничения за лечение.
Минималните ефективни дози, които могат да се използват през първия период на лечение, са 0,03-0,06 mg/kg телесно тегло. Най-ефективните дози са 2-4 mg 3 пъти седмично. Увеличаването на единичната доза до 10 mg не е съпроводено с адекватно повишаване на растежния ефект, но е довело до бързо образуване на антитела срещу соматотропин.
В нашата страна работата по изучаване на човешкия растежен хормон се провежда от 1960 г. Изпитани са два режима на лечение: непрекъснат и интермитентен с курсове от 2-3 месеца и същите интервали между тях. Средното увеличение на ръста на пациентите през първата година от лечението е 9,52±0,39 см, увеличението на телесното тегло е 4,4±0,14 кг. При продължително непрекъснато лечение средното увеличение на ръста е 0,82 см/месец, телесното тегло - 0,38 кг/месец; при интермитентно - съответно 0,75 см/месец и 0,4 кг/месец. Непрекъснатото лечение осигурява по-бързо увеличение на ръста с рязко намаляване на ефекта след 1-1,5 години, а при интермитентно лечение ефективността се запазва в продължение на 3-4 години, което ни позволява да считаме курсовия режим на лечение за по-подходящ. Определянето на нивото на IGF-I (соматомедин С) може да служи като надежден индикатор за чувствителността на пациента към лечение със соматотропинови препарати. Увеличаването на съдържанието на IGF-I след въвеждането на соматотропен хормон позволява да се предвиди положителен ефект от терапията. Важно предимство на лечението със соматотропин е липсата на ускорение на скелетната осификация на негов фон.
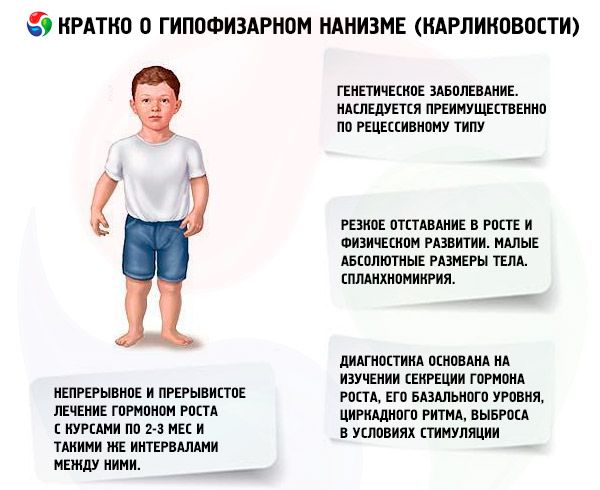
Най-важното средство за лечение на нанизма е употребата на анаболни стероиди, които стимулират растежа чрез засилване на протеиновия синтез и повишаване на нивото на ендогенен соматотропен хормон. Лечението се провежда в продължение на няколко години, с постепенна замяна на някои лекарства с други, от по-малко активни към по-активни съединения. Смяната на анаболните лекарства е показана, когато растежният ефект намалее след 2-3 години, което води до допълнително увеличаване на растежа. Лечението се провежда на курсове (периодът на почивка трябва да бъде половината от периода на лечение). В случай на пристрастяване са показани и по-дълги почивки (до 4-6 месеца). Предписва се само един от анаболните стероиди едновременно. Комбинирането на 2 или повече лекарства е неподходящо, тъй като това не засилва техните метаболитни и растежни ефекти. Последното зависи преди всичко от възрастта на пациентите и степента на диференциация на скелетните кости в началото на лечението. Най-добър ефект се наблюдава при пациенти под 16-18 години със скелетна осификация, която не надвишава нивото, характерно за 14-годишно лице. Препоръчително е лечението да започне веднага след поставяне на диагнозата, обикновено от 5-7-годишна възраст. Преди лечение е необходимо да се избягва предписването на гонадотропини и полови хормони, които, стимулирайки растежа, едновременно с това ускоряват скелетната диференциация. Принципът на дозиране на анаболните стероиди е от минималните ефективни дози до постепенно увеличаващи се. Препоръчителните дози на най-разпространените лекарства са: неробол (метандростенол, дианабол) - 0,1-0,15 mg на 1 kg телесно тегло на ден перорално; нероболил (дураболин) - 1 mg на 1 kg телесно тегло на месец интрамускулно, като месечната доза се прилага съответно в 2-3 дози след 15 или 10 дни; ретаболил (дека-дураболин) - 1 mg на 1 kg телесно тегло веднъж месечно интрамускулно. Превишаването на посочените дози може да доведе до андрогенизация. Във физиологични дози тези съединения не повлияват значително състоянието на гениталиите и диференциацията на скелетните кости, което позволява продължителната им употреба при пациенти от двата пола. Момичетата трябва да бъдат под наблюдението на гинеколог, тъй като в случай на предозиране или повишена индивидуална чувствителност, някои пациенти могат да развият признаци на вирилизация, които бързо регресират след прекратяване на лечението. Пероралните лекарства, метилирани до етилирани на 17-та позиция, понякога могат да причинят холестатичен ефект, следователно при чернодробни заболявания трябва да се даде предимство на парентерални анаболни съединения или пероралните лекарства трябва да се комбинират с холеретични средства. Много рядко лечението с анаболни стероиди може да причини алергични реакции (сърбеж, обриви). При липса на усложнения, анаболните стероиди се използват, докато се наблюдава растежен ефект (до 16-18 години, а понякога и по-дълго). Лечението се провежда на фона на общоукрепваща терапия.
Ако пациентите имат признаци на хипотиреоидизъм, лекарства за щитовидната жлеза (тироксин, тиреоидин, тиреотомин) се предписват едновременно в индивидуално подбрани дози.
При лечението на момчета следващата стъпка е прилагането на човешки хорионгонадотропин. Това лекарство се използва не по-рано от 15-16 години, а често и в още по-късна възраст за стимулиране на Лайдиговите клетки, което ускорява както половото развитие, така и растежа (поради анаболната активност на собствените им андрогени). Дози от 1000 до 1500 IU се прилагат 1-2 пъти седмично интрамускулно в 2-месечни курсове не повече от 2-3 пъти годишно. Ако ефектът е непълен, лечението с човешки хорионгонадотропин при момчета на 16 и повече години се редува с прилагането на малки дози андрогени (метилтестостерон в доза 5-10 mg/ден сублингвално).
Момичета над 16-годишна възраст могат да започнат лечение с малки дози естрогени, симулиращи нормален полов цикъл. Лечението се провежда в продължение на 3 седмици всеки месец, последвано от почивка. Във втората фаза на цикъла, от 3-тата седмица, може да се предпише хорионгонадотропин в доза от 1000-1500 IU 3-5 пъти седмично или лекарства с гестагенен ефект (прегнин, прогестерон).
Последният етап от лечението (след затварянето на зоните на растеж) е постоянното прилагане на терапевтични дози полови хормони, съответстващи на пола на пациента, с цел пълноценно развитие на гениталиите, вторичните полови белези, осигуряване на либидото и половата потентност. Комбинираните естроген-прогестогенни препарати (нон-овлон, бисекурин, инфекундин, ригевидон) са удобни за лечение на жени, а андрогенните препарати с удължено освобождаване (тестенат, сустанон-250, омнадрен-250) са удобни за лечение на мъже.
Провежда се общоукрепващо лечение (режим, протеиново-зеленчукова диета, витаминна терапия, биостимуланти). Показано е използването на цинкови препарати, в механизма на действие на които основна роля играе повишаването на активността на IGF-1 (инсулиноподобен растежен фактор I).
При наличие на органична патология от страна на централната нервна система се прилага противовъзпалителна, резорбтивна и дехидратираща терапия. Целенасочената системна терапия дава обнадеждаващ ефект. В резултат на дългосрочно поетапно лечение, 148 (80,4%) от 175 пациенти с нанизъм от двата пола са успели да постигнат ръст над 130 см, 92 (52,5%) - над 140 см, а 32 (18,3%) - 150-160 см или повече. В същото време, 37 пациенти (21,2%) са увеличили ръста си с 30 см, 107 (61,1%) с 31-50 см, а 31 (17,7%) с 51-60 см или повече.
Прогноза
Прогнозата зависи от формата на нанизъм. При генетичните видове нанизъм прогнозата за живот е благоприятна. При наличие на тумор на хипофизата и органично увреждане на централната нервна система, тя се определя от динамиката на развитието на основния патологичен процес. Съвременните методи на терапия значително са увеличили физическите възможности и работоспособността на пациентите и са удължили продължителността на живота им. По време на периода на активно лечение пациентите е необходимо да бъдат преглеждани от лекар на всеки 2-3 месеца, при поддържаща терапия - на всеки 6-12 месеца.
Заетостта на пациентите, която съответства на техните интелектуални и физически възможности, е от първостепенно значение за тяхната социална адаптация.
Препоръчително е да избирате професии, които не са свързани с тежки физически натоварвания, но ви позволяват да демонстрирате интелектуални способности, умение за прецизна работа и езици.


 [
[