Медицински експерт на статията
Нови публикации
Причини и патогенеза на дифтерията
Последно прегледани: 04.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Дифтерията е парадигма на токсигенните инфекциозни заболявания. През 1883 г. Клебс демонстрира, че Corynebacterium diphtheriae е причинителят на дифтерията. Година по-късно Льофлер открива, че организмът може да се култивира само от назофарингеалната кухина и предполага, че увреждането на вътрешните органи се дължи на разтворим токсин. До 1888 г. Ру и Йерсен показват, че животни, инжектирани със стерилни филтрати на C. diphtheriae, развиват органна патология, неразличима от тази при човешка дифтерия; това демонстрира, че мощен екзотоксин е основният фактор на вирулентност.
Дифтерията е най-често инфекция на горните дихателни пътища, причиняваща треска, болки в гърлото и неразположение. Дебела, сиво-зелена фибринова мембрана, псевдомембрана, често се образува на мястото(ата) на инфекцията в резултат на комбинираните ефекти от бактериалния растеж, производството на токсини, некрозата на подлежащата тъкан и имунния отговор на гостоприемника. Признаването, че системното увреждане на органите се дължи на действието на дифтерийния токсин, доведе до разработването както на ефективна терапия на базата на антитоксин за лечение на остра инфекция, така и на високоефективна токсоидна ваксина.
Въпреки че имунизацията с токсоиди е направила дифтерията рядко заболяване в райони, където стандартите за обществено здраве изискват ваксинация, огнища на дифтерия все още се появяват сред неимунизирани и имунокомпрометирани групи. За разлика от това, широко разпространени огнища на дифтерия, достигащи епидемични размери, са се появили в райони, където програмите за активна имунизация са били преустановени.
Други видове коринебактерии
В допълнение към C. diphtheriae, C. ulcerans и C. pseudotuberculosis, C. pseudodiphtheriticum и C. xerosis могат понякога да причинят назофарингеални и кожни инфекции. Последните два щама са разпознаваеми по способността си да произвеждат пиразинамидаза. Във ветеринарната медицина C. renale и C. kutscheri са важни патогени, причиняващи съответно пиелонефрит при говеда и латентни инфекции при мишки.
Причини
Причинителят на дифтерия, Corynebacterium diphtheriae, е тънка, леко извита пръчка с удебеления във формата на клубчета в краищата, неподвижна; не образува спори, капсули или флагели и е грам-положителна.
В допълнение към токсина, дифтерийните коринебактерии по време на жизнените си процеси произвеждат невраминидаза, хиалуронидаза, хемолизин, некротизиращи и дифузни фактори, които могат да причинят некроза и втечняване на основното вещество на съединителната тъкан.
Въз основа на способността им да образуват токсини, дифтерийните коринебактерии се разделят на токсигенни и нетоксигенни.
Дифтерийният токсин е мощен бактериален екзотоксин, който определя както общите, така и локалните клинични прояви на заболяването. Токсигенността е генетично обусловена. Нетоксигенните коринебактерии на дифтерия не причиняват заболяването.
Според културните и морфологичните характеристики, всички дифтерийни коринебактерии се разделят на 3 варианта: gravis, mitis, intermedius. Няма пряка зависимост на тежестта на заболяването от варианта на дифтерийните коринебактерии. Всеки вариант съдържа както токсигенни, така и нетоксигенни щамове. Токсигенните коринебактерии от всички варианти произвеждат идентичен токсин. [ 1 ]
Структура, класификация и видове антигени
Corynebacterium diphtheriae е Грам-положителна, неподвижна, пръчковидна бактерия с форма на бухол. Щамовете, растящи в тъкан или по-стари in vitro култури, съдържат фини петънца в клетъчните стени, които позволяват обезцветяване по време на оцветяване по Грам и водят до променлива Грам реакция. По-старите култури често съдържат метахроматични гранули (полиметафосфат), които се оцветяват в синкаво-лилаво с метиленово синьо. Захарите в клетъчната стена включват арабиноза, галактоза и маноза. Освен това може да се изолира токсичният 6,6'-естер на трехалозата, съдържащ коринемиколенова и коринемиколенова киселини в еквимоларни концентрации. Разпознават се три различни типа култури: mitis, intermedius, gravis.
Повечето щамове се нуждаят от никотинова и пантотенова киселини за растеж; някои също изискват тиамин, биотин или пимелинова киселина. За оптимално производство на дифтериен токсин, средата трябва да бъде допълнена с аминокиселини и трябва да бъде оставена настрана.
Още през 1887 г. Льофлер описва изолирането на авирулентни (нетоксигенни) C. diphtheriae, които са неразличими от вирулентни (токсигенни) щамове, изолирани от пациенти при здрави индивиди. Сега е признато, че авирулентните щамове на C. diphtheriae могат да бъдат превърнати във вирулентен фенотип след инфекция и лизогенизация от един от редица различни коринебактериофаги, носещи структурния ген за дифтериен токсин, tox. Лизогенното превръщане на авирулентния във вирулентен фенотип може да се случи както in situ, така и in vitro. Структурният ген за дифтериен токсин не е от съществено значение нито за коринебактериофага, нито за C. diphtheriae. Въпреки това наблюдение, не е наблюдаван генетичен дрейф на дифтериен токсин.
Патогенеза
Входните точки на инфекцията са лигавиците на орофаринкса, носа, ларинкса, по-рядко лигавицата на очите и гениталиите, както и увредена кожа, раневи или изгорени повърхности, обрив от пелени, незаздравяла пъпна рана. На входната точка дифтерийната коринебактерия се размножава и отделя екзотоксин.
Ексудат, богат на фибриноген, се отделя и превръща във фибрин под въздействието на тромбокиназа, отделена по време на некроза на епителните клетки. Образува се фибринозен филм - характерен признак на дифтерия.
Асимптоматичното назофарингеално носителство е често срещано в ендемични за дифтерия райони. При чувствителни индивиди, токсигенните щамове причиняват заболяване чрез репликиране и секретиране на дифтериен токсин в назофаринкса или кожните лезии. Дифтерийната лезия често е покрита от псевдомембрана, съставена от фибрин, бактерии и възпалителни клетки. Дифтерийният токсин може да бъде протеолитично разцепен на два фрагмента: N-терминален фрагмент А (каталитичен домен) и фрагмент В (трансмембранен и рецептор-свързващ домен). Фрагмент А катализира NAD+-зависимото ADP-рибозилиране на елонгационния фактор 2, като по този начин инхибира протеиновия синтез в еукариотните клетки. Фрагмент В се свързва с рецептор на клетъчната повърхност и улеснява доставянето на фрагмент А до цитозола.
Защитният имунитет включва антителния отговор към дифтериен токсин след клинично заболяване или към дифтериен токсин (токсин, инактивиран от формалдехид) след имунизация.
Колонизация
Малко се знае за факторите, които медиират колонизацията на C. diphtheriae. Ясно е обаче, че фактори, различни от производството на дифтериен токсин, допринасят за вирулентността. Епидемиологични проучвания показват, че даден лизотип може да персистира в популацията за дълги периоди от време. По-късно той може да бъде заменен от друг лизотип. Появата и последващото доминиране на нов лизотип в популацията вероятно е свързано със способността му да колонизира и да се конкурира ефективно в своя сегмент от назофарингеалната екологична ниша. Corynebacterium diphtheriae може да произвежда невраминидаза, която разцепва сиаловата киселина на клетъчната повърхност на нейните компоненти пируват и N-ацетилневраминова киселина. Кордовият фактор (6,6'-ди-O-миколоил-α, α'-D-трехалоза) е повърхностен компонент на C. diphtheriae, но ролята му в колонизацията на човешкия гостоприемник е неясна.
Производство на дифтерийни токсини
Структурният ген на дифтерийния токсин, tox, принадлежи към семейство тясно свързани коринебактериофаги, от които β-фагът е най-добре проучен. Регулацията на експресията на дифтерийния токсин се медиира от желязо-активиран репресор, DtxR, който е кодиран от генома на C. diphtheriae. Експресията на токсина зависи от физиологичното състояние на C. diphtheriae. При условия, при които желязото се превръща в субстрат, ограничаващ скоростта на растеж, желязото се дисоциира от DtxR, генът на токсикодендрон се активира и дифтерийният токсин се синтезира и секретира в културалната среда с максимална скорост.
Дифтерийният токсин е необичайно силен; за чувствителни видове (напр. хора, маймуни, зайци, морски свинчета) дори 100 до 150 ng/kg телесно тегло е смъртоносна. Дифтерийният токсин се състои от една полипептидна верига от 535 аминокиселини. Биохимичният, генетичният и рентгеноструктурният анализ показват, че токсинът се състои от три структурни/функционални домена:
- N-терминална ADP-рибозилтрансфераза (каталитичен домен);
- регион, който улеснява доставянето на каталитичния домен през клетъчната мембрана (трансмембранен домен);
- свързващ домейн на еукариотния клетъчен рецептор.
След леко трипсиново смилане и редукция при денатуриращи условия, дифтерийният токсин може да бъде специфично разцепен в своята протеазно-чувствителна бримка на два полипептидни фрагмента (А и В). Фрагмент А е N-терминалният 21 kDa компонент на токсина и съдържа каталитичния сайт за ADP-рибозилиране на елонгационен фактор 2 (EF-2).
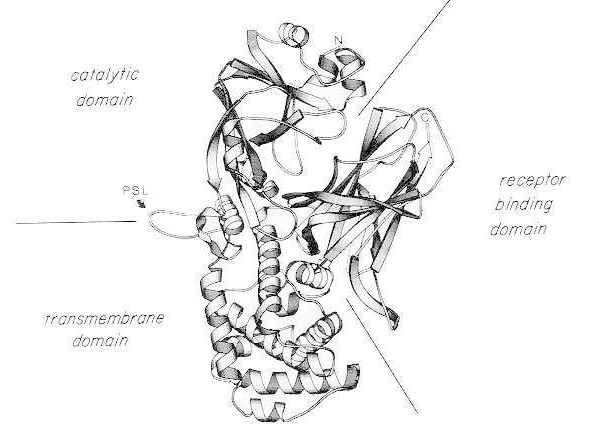
Лентова диаграма на рентгеновата кристална структура на мономерен нативен дифтериен токсин. (модифицирано от Bennett MJ, Choe S, Eisenberg D: Размяна на домейни: Заплитащи връзки между протеини. Proc Natl Acad Sci, USA, 91: 3127, 1994). Показани са относителните позиции на каталитичните, трансмембранните и рецептор-свързващите домени. Интактният токсин може да бъде разцепен от трипсиноподобни протеази при Arg190, Arg192 и/или Arg193, които са разположени в протеазно-чувствителната бримка (PSL). След редукция на дисулфидния мост между Cys186 и Cys201, токсинът може да бъде разделен на А и В фрагменти. Показани са амино-краят (N) и карбокси-краят (C) на интактния токсин. Лентовата диаграма е създадена с помощта на програмата MOLESCRIPT.
С-терминалният фрагмент, фрагмент В, носи трансмембранния и рецептор-свързващия домен на токсина.
Отравянето на една еукариотна клетка с дифтериен токсин включва поне четири отделни стъпки:
- свързване на токсина с неговия рецептор на клетъчната повърхност;
- групиране на заредени рецептори в покрити ямки и интернализация на токсина чрез рецепторно-медиирана ендоцитоза; след подкисляване на ендоцитния везикул от мембранно-свързана, АТФ-задвижвана протонна помпа,
- вмъкване на трансмембранния домен в мембраната и улесняване на доставянето на каталитичния домен в цитозола, и
- ADP-рибозилиране на EF-2, което води до необратимо потискане на протеиновия синтез.
Доказано е, че една-единствена молекула от каталитичния домен, доставена в цитозола, е достатъчна, за да бъде летална за клетката.
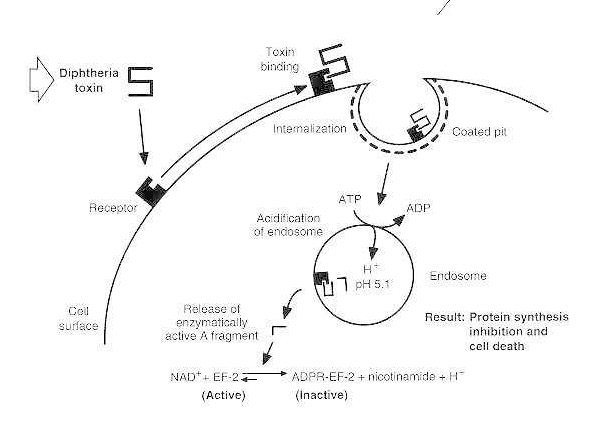
Схематична диаграма на дифтерийна интоксикация на чувствителна еукариотна клетка.
Токсинът се свързва с рецептора на клетъчната повърхност и се интернализира чрез рецептор-медиирана ендоцитоза; при подкисляване на ендозома, трансмембранният домен се вмъква в мембраната на везикулата; каталитичният домен се доставя до цитозола, което води до инхибиране на протеиновия синтез и клетъчна смърт.
Епидемиология
Преди масовата имунизация на населението на САЩ с дифтериен токсоид, дифтерията обикновено е била детско заболяване. Забележителен аспект на масовата имунизация с дифтериен токсоид е, че с увеличаването на процента на населението със защитни нива на антитоксичен имунитет (≥ 0,01 IU/mL), честотата на изолиране на токсигенни щамове от населението намалява. Днес в Съединените щати, където клиничната дифтерия е почти напълно изчезнала, изолирането на токсигенни щамове на C. diphtheriae е рядкост. Тъй като субклиничната инфекция вече не осигурява източник на излагане на дифтериен антиген и, освен ако не се стимулира, имунитетът към антитоксин намалява, голям процент от възрастните (30 до 60%) имат нива на антитоксин под защитните нива и са изложени на риск. В Съединените щати, Европа и Източна Европа, скорошни огнища на дифтерия са възникнали предимно сред лица, които злоупотребяват с алкохол и/или наркотици. В тази група носителите на токсигенен C. diphtheriae имат умерено високо ниво на антитоксичен имунитет. Неотдавнашният срив на мерките за обществено здраве в Русия доведе до превръщането на дифтерията в епидемия. До края на 1994 г. в Русия са регистрирани над 80 000 случая и над 2000 смъртни случая.
Огнищните огнища на дифтерия почти винаги са свързани с имунен носител, който се е завърнал от регион, където дифтерията е ендемична. Всъщност, скорошни огнища на клинична дифтерия в Съединените щати и Европа са свързани с пътуващи, завръщащи се от Русия и Източна Европа. Токсигенните щамове на C. diphtheriae се предават директно от човек на човек чрез въздушно-капковидни капчици. Известно е, че токсигенните щамове могат директно да колонизират назофарингеалната кухина. Освен това, токсигенният ген може да се разпространява индиректно чрез освобождаване на токсигенен коринебактериофаг и лизогенна трансформация на нетоксигенен автохтонен C. diphtheriae in situ. [ 5 ]
В допълнение към определянето на биотипа и лизотипа на изолатите на C. diphtheriae, техниките на молекулярната биология вече могат да се използват за изследване на дифтерийни огнища. Моделите на рестрикционно ендонуклеазно разграждане на хромозомната ДНК на C. diphtheriae са използвани за изследване на клинични огнища, както и използването на клонирани коринебактериални инсерционни последователности като генетична сонда.
Шик тестът се използва от много години за оценка на имунитета към дифтериен токсин, въпреки че в много области вече е заменен от серологичен тест за специфични антитела към дифтериен токсин. При Шик теста малко количество дифтериен токсин (приблизително 0,8 ng в 0,2 ml) се инжектира интрадермално в предмишницата (мястото на изследване) и 0,0124 μg дифтериен токсин в 0,2 ml се инжектира интрадермално в контролното място. Отчитанията се правят на 48 и 96 часа. Неспецифичните кожни реакции обикновено достигат пик на 48 часа. На 96 часа, еритематозна реакция с възможна некроза на мястото на изследване показва недостатъчен антитоксичен имунитет за неутрализиране на токсина (≤ 0,03 IU/ml). Възпалението както в тестовата, така и в контролната зона след 48 часа показва реакция на свръхчувствителност към антигенния препарат.
Форми
Corynebacterium diphtheriae инфектира назофаринкса или кожата. Токсигенните щамове произвеждат мощен екзотоксин, който може да причини дифтерия. Симптомите на дифтерия включват фарингит, треска и подуване на врата или областта около кожната лезия. Дифтерийните лезии са покрити от псевдомембрана. Токсинът се разпространява чрез кръвния поток до отдалечени органи и може да причини парализа и застойна сърдечна недостатъчност. [ 6 ]
Съществуват два вида клинична дифтерия: назофарингеална и кожна. Симптомите на фарингеална дифтерия варират от лек фарингит до хипоксия, дължаща се на запушване на дихателните пътища от псевдомембрана. Засягането на шийните лимфни възли може да причини тежко подуване на врата (дифтерия тип „бичи врат“) и пациентът може да развие треска (≥ 38°C). Кожните лезии при кожна дифтерия обикновено са покрити от сиво-кафява псевдомембрана. В резултат на действието на дифтерийния токсин върху периферните моторни неврони и миокарда могат да се развият животозастрашаващи системни усложнения, главно загуба на двигателна функция (напр. затруднено преглъщане) и застойна сърдечна недостатъчност.
Контрол
Контролът на дифтерията зависи от адекватната имунизация с дифтериен токсоид: дифтериен токсин, инактивиран от формалдехид, който остава антигенно непокътнат. Токсоидът се приготвя чрез инкубиране на дифтериен токсин с формалдехид при 37°C в алкални условия. Имунизацията срещу дифтерия трябва да започне през втория месец от живота със серия от три първични дози на интервали от 4 до 8 седмици, последвани от четвърта доза приблизително 1 година след последната първична ваксина. Дифтериен токсоид се използва широко като компонент на ваксината срещу дифтерия, коклюш и тетанус (DPT). Епидемиологични проучвания показват, че имунизацията срещу дифтерия е приблизително 97% ефективна. Въпреки че масова имунизация срещу дифтерия се практикува в Съединените щати и Европа и нивата на имунизация в детска възраст са адекватни, голяма част от възрастното население може да има титри на антитела под защитните нива. Възрастните трябва да се реваксинират с дифтериен токсоид на всеки 10 години. Всъщност, бустерна имунизация с дифтерия-тетаничен токсоид трябва да се прилага на пътуващи в райони с високи нива на ендемична дифтерия (Централна и Южна Америка, Африка, Азия, Русия и Източна Европа). През последните години използването на високо пречистени токсоидни препарати за имунизация е минимизирало случайните тежки реакции на свръхчувствителност. Бустерна имунизация с дифтерия-тетаничен токсоид трябва да се прилага на пътуващи в райони с високи нива на ендемична дифтерия (Централна и Южна Америка, Африка, Азия, Русия и Източна Европа). През последните години използването на високо пречистени токсоидни препарати за имунизация е минимизирало случайните тежки реакции на свръхчувствителност. Бустерна имунизация с дифтерия-тетаничен токсоид трябва да се прилага на пътуващи в райони с високи нива на ендемична дифтерия (Централна и Южна Америка, Африка, Азия, Русия и Източна Европа). През последните години използването на високо пречистени токсоидни препарати за имунизация е минимизирало случайните тежки реакции на свръхчувствителност.
Въпреки че антибиотици (като пеницилин и еритромицин) се използват като част от лечението на пациенти с дифтерия, бързата пасивна имунизация с дифтериен антитоксин е най-ефективна за намаляване на смъртността. Дългият полуживот на специфичния антитоксин в кръвния поток е важен фактор за осигуряване на ефективна неутрализация на дифтерийния токсин; за да бъде ефективен обаче, антитоксинът трябва да реагира с токсина, преди да може да влезе в клетката.
Реинженеринг на дифтериен токсин за разработване на еукариотни рецептор-специфични цитотоксини
Протеиновото инженерство е нова и бързо развиваща се област в молекулярната биология; тя комбинира методологии на рекомбинантна ДНК и твърдофазен синтез на ДНК, за да проектира и конструира химерни гени, чиито продукти имат уникални свойства. Изследванията на структурно-функционалните връзки на дифтерийния токсин ясно показват, че този токсин е тридоменен протеин: каталитичен, трансмембранен и рецепторен. Възможно е генетично да се замени естественият рецептор-свързващ домейн на дифтерийния токсин с различни полипептидни хормони и цитокини (напр. α-меланоцит-стимулиращ хормон [α-MSH], интерлевкин (IL) 2, IL-4, IL-6, IL-7, епидермален растежен фактор). Получените химерни протеини или фузионни токсини комбинират рецептор-свързващата специфичност на цитокина с трансмембранния и каталитичните домейни на токсина. Във всеки случай е доказано, че фузионните токсини селективно отравят само онези клетки, които носят съответния целеви рецептор. Първият от тези генетично модифицирани слети токсини, DAB 389IL-2, понастоящем се оценява в клинични изпитвания върху хора за лечение на рефрактерни лимфоми и автоимунни заболявания, при които клетки с високоафинитетни IL-2 рецептори играят важна роля в патогенезата.[ 7 ] Приложението на DAB 389 IL-2 се оказва безопасно, добре поносимо и способно да индуцира трайна ремисия на заболяването без сериозни странични ефекти. Вероятно слетите токсини на базата на дифтериен токсин ще се превърнат във важни нови биологични агенти за лечение на специфични тумори или заболявания, при които могат да бъдат насочени специфични рецептори на клетъчната повърхност.


 [
[