Медицински експерт на статията
Нови публикации
Абдоминален абсцес
Последно прегледани: 04.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
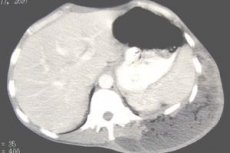
Абдоминалният абсцес е възпаление на коремните органи с гноен характер с последващото им разтапяне и образуване на гнойна кухина с различен размер с наличието на пиогенна капсула. Може да се образува във всяка част на коремната кухина с образуването на редица клинични синдроми: септичен, интоксикационен, фебрилен.
Епидемиология
Броят на хирургичните интервенции, извършвани на коремните органи, непрекъснато нараства. Това, употребата на огромен брой различни антибиотици, както и силното отслабване на имунната система на организма поради бързата урбанизация, води до честото развитие на следоперативни абсцеси в коремната област. Според статистиката, следоперативните усложнения под формата на образуване на абсцеси се развиват при 0,8% от пациентите след планови коремни операции и при 1,5% след спешни операции.
Причини абдоминален абсцес
Като правило, абсцесите в коремната кухина се развиват след различни наранявания, инфекциозни заболявания на стомашно-чревния тракт, възпалителни процеси в органите, разположени в коремната кухина, както и в резултат на перфорация на дефект при стомашна язва или язва на дванадесетопръстника.
Основни причини:
- Последица от вторичен перитонит (перфориран апендицит; анастомотична недостатъчност след коремна операция, панкреатична некроза след операция, травматични увреждания) и др.
- Възпаление на вътрешните женски полови органи с гноен характер (салпингит, възпаление на яйчниковите придатъци, гноен параметрит, пиосалпинкс, тубо-овариални абсцеси).
- Остър панкреатит и холецистит, неспецифичен улцерозен колит.
Остеомиелит на гръбначния стълб, спондилит с туберкулозна етиология, възпаление на периреналната тъкан.
Основните патогени на абсцесите са аеробната (Escherichia coli, Proteus, Staphylococcus и Streptococcus и др.) и анаеробната (Clostridium, Bacteroides fragilis, Fusobacteriales) бактериална флора.
Рискови фактори
Много често абсцесите в коремната кухина се развиват в резултат на хирургични интервенции на коремните органи (най-често след операции на жлъчните пътища, панкреаса, червата). Има случаи, при които перитонеумът се инфектира след интервенцията, особено при неуспех на анастомозата.
В 70% от случаите абсцесът се развива в интраперитонеалната или ретроперитонеалната област; в 30% той е локализиран вътре в орган.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Патогенеза
Абдоминален абсцес се развива в резултат на хиперреактивността на имунната система с активен растеж и размножаване на стрептококова и стафилококова флора, както и на E. coli (апендикуларен абсцес). Патогените проникват в коремната кухина по лимфогенен или хематогенен път, както и чрез контакт през фалопиевите тръби, когато има деструктивно възпаление на органите или органа, нараняване, перфорация, неуспех на конците, наложени по време на хирургическа интервенция.
Основната разлика на абсцеса на корема е фактът, че огнището на възпалението е ясно разграничено от здравите тъкани, които го заобикалят. Ако пиогенната мембрана е разрушена, се развива сепсис и гнойни изтичания. Абсцесите могат да бъдат единични или множествени.
Симптоми абдоминален абсцес
Първите признаци на абсцес на коремната област варират, но в повечето случаи пациентите изпитват:
- Рязка треска, втрисане, които са съпроводени с леки усещания за дърпане в коремната област, които се усилват при палпация.
- Често желание за уриниране (тъй като коремната кухина е разположена близо до пикочния мехур).
- Запек.
- Гадене, което може да бъде придружено от повръщане.
Също така, други обективни симптоми на абсцес на корема са:
- Тахикардия, високо кръвно налягане.
- Напрежение на мускулите на предната коремна стена.
Ако абсцесът е субдиафрагмален, основните симптоми включват също:
- Болка в областта на хипохондриума, която може да се засили по време на вдишване и да се разпространява към лопатката.
- Чрез промяна на походката на пациента, той започва да накланя тялото си към страната на дискомфорта.
- Висока телесна температура.
Усложнения и последствия
Ако абсцесът на корема не бъде диагностициран навреме и не се започне правилно лечение, могат да възникнат доста сериозни последици:
Ето защо, ако почувствате някакъв дискомфорт или болка в коремната област, трябва незабавно да потърсите помощ от гастроентеролог или терапевт.
Диагностика абдоминален абсцес
Основните диагностични методи са:
- Рентгенова снимка на гръдния кош и коремните органи.
- Ултразвуково изследване.
- КТ и ЯМР като помощни диагностични методи.
- Вземане на пункция от задния вагинален форникс или предната стена на ректума (ако има съмнение за развитие на абсцес на зоната на Дъглас).
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ]
Тестове
Ако абсцесът не може да бъде диагностициран поради липса на каквито и да е симптоми, могат да бъдат предписани изследвания, включително пълна кръвна картина. При това заболяване пациентът почти винаги има левкоцитоза, понякога неутрофилия (рязко изместване на левкоцитната формула наляво), както и повишаване на СУЕ.
 [ 40 ], [ 41 ], [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ]
[ 40 ], [ 41 ], [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ]
Инструментална диагностика
Рентгеновите снимки на гръдния кош могат да покажат, че куполът на диафрагмата е повдигнат от засегнатата страна. В плевралната област може да се наблюдава реактивен излив. При субдиафрагмални абсцеси на рентгеновите снимки може да се види газов мехур и ниво на течност под него.
Ултразвукови признаци на абсцес на корема
„Златният“ стандарт за диагностициране на коремни абсцеси с различна локализация е ултразвуковото изследване. Ултразвуковите признаци са: ясно очертано течно образувание в капсулата, чието съдържание е хетерогенно и прилича на нишковидна структура или ехогенна суспензия. Възниква така нареченият ефект на газова реверберация, когато многократните отражения на звука постепенно намаляват интензитета му.
Лечение абдоминален абсцес
Лечението включва операция за отстраняване на абсцеса и дренирането му с помощта на катетър.
Медикаментите не лекуват абсцес на корема, но различни антибиотици могат да ограничат разпространението на инфекцията. Ето защо лекарите ги предписват на пациентите преди и след операция. Те използват главно лекарства, които могат да потиснат развитието на чревната микрофлора. В някои случаи се препоръчват и антибиотици, които са активни срещу анаеробни бактерии, включително Pseudormonas.
Лекарства
Метронидазол. Ефективен антимикробен и антипротозойен агент. Лекарството съдържа активното вещество метронидазол. То е способно да редуцира 5-нитро групата на вътреклетъчните протеини в протозои и анаеробни бактерии. След редукцията, тази нитро група взаимодейства с ДНК на бактериите, в резултат на което синтезът на нуклеинови киселини на патогените се инхибира и те умират.
Метронидазолът е ефективен срещу амеби, трихомонади, бактероиди, пептококи, фузобактерии, еубактерии, пептострептококи и клостридии.
Метронидазолът има висока абсорбция и ефективно прониква в засегнатите тъкани и органи. Дозировката е индивидуална и се определя от лекуващия лекар в зависимост от състоянието на пациента. Пациенти с непоносимост към метронидазол, анамнеза за епилепсия, заболявания на централната и периферната нервна система, левкопения и нарушена чернодробна функция, не могат да използват лекарството. Също така не трябва да се предписва по време на бременност.
В някои случаи употребата на лекарството може да причини: повръщане, анорексия, диария, глосит, панкреатит, мигрена, световъртеж, депресия, алергии, дизурия, полиурия, кандидоза, често уриниране, левкопения.
Предотвратяване
Превантивните мерки се основават на адекватно и навременно лечение на различни заболявания на органи, разположени в коремната кухина. Също така е много важно да се постави правилна диагноза при остър апендицит навреме и да се извърши операция за отстраняването му.
 [ 47 ], [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ]
[ 47 ], [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ]

