Медицински експерт на статията
Нови публикации
Вирус на човешкия имунодефицит (HIV)
Последно прегледани: 04.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Синдромът на придобита имунна недостатъчност е идентифициран като специфично заболяване през 1981 г. в Съединените щати, когато редица млади хора развиват сериозни заболявания, причинени от микроорганизми, които са непатогенни или слабо патогенни за здрави хора. Проучване на имунния статус на пациентите разкрива рязко намаляване на броя на лимфоцитите като цяло и на Т-хелперите в частност. Това състояние е наречено СПИН (синдром на придобита имунна недостатъчност). Методът на заразяване (сексуален контакт, чрез кръв и нейни препарати) показва инфекциозния характер на заболяването.
Причинителят на СПИН е открит през 1983 г. независимо от французина Л. Монтание, който го нарича LAV Lymphoadenopathy Associated Virus (ВИРУС, асоцииран с лимфаденопатия), тъй като го открива при пациент с лимфаденопатия; и американеца Р. Гало, който нарича вируса HTLV-III (Човешки Т-лимфотропен вирус III): преди това той е открил лимфотропни вируси I и II.
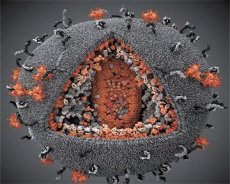
Сравнение на свойствата на вирусите LAV и HTLV-III показа тяхната идентичност, така че за да се избегне объркване, през 1986 г. вирусът е наречен HIV (вирус на човешката имунна недостатъчност или HIV). HIV е със сферична форма, с диаметър 110 nm. Вирусната обвивка има формата на многоъгълник, съставен от 12 петоъгълника и 20 шестоъгълника. В центъра и ъглите на всеки шестоъгълник се намира молекула гликозилиран протеин gpl20 (числото 120 показва молекулното тегло на протеина в килодалтони). Общо 72 молекули gpl20 са разположени на повърхността на вириона под формата на своеобразни шипове, всеки от които е свързан с интрамембранния протеин gp41. Тези протеини, заедно с двойния липиден слой, образуват суперкапсида (мембраната) на вириона.
Протеините gpl20 и gp41 се образуват чрез разрязване на прекурсорния протеин Env от клетъчна протеаза. Протеинът gp41 образува шиповидното „стъбло“ чрез свързване с цитоплазмения си домен с матричния протеин p17MA, разположен директно под обвивката. Молекулите p17 взаимодействат по време на узряването на вириона, за да образуват икосаедър под обвивката.
В централната част на вириона, протеинът p24 образува конусовидна капсид. Стеснената част на капсида е свързана с вирионната мембрана с участието на протеина rb. Вътре в капсида се намират две идентични молекули вирусна геномна РНК. Те са свързани чрез своите 5' краища с нуклеокапсидния протеин p7NC. Този протеин е интересен, защото има два аминокиселинни остатъка (мотива), богати на цистеин и хистидин и съдържащи Zn атом - те се наричат "цинкови пръсти", защото улавят молекули геномна РНК за включване във формиращите се вириони. Капсидът съдържа и три ензима. Ревертазата (RT), или pol комплекс, включва обратна транскриптаза, RNase H и ДНК-зависима ДНК полимераза. Ревертазата присъства като хетеродимер p66/p51. Протеазата (PR) - p10, инициира и осъществява процеса на узряване на вириона. Интеграза (IN) - p31, или ендонуклеаза, осигурява включването на провирусна ДНК в генома на клетката гостоприемник. Капсидът съдържа също молекула праймерна РНК (tRNA1"3).
РНК геномът в клетката се преобразува в ДНК геном (ДНК провирус) с помощта на обратна транскриптаза, състоящ се от 9283 нуклеотидни двойки. Той е ограничен отляво и отдясно от така наречените дълги терминални повторения или LTR: S'-LTR отляво и 3'-LTR отдясно. LTR съдържат по 638 нуклеотидни двойки.
Геномът на ХИВ се състои от 9 гена, някои от които се припокриват в краищата си (имат няколко рамки за четене) и имат екзонинтронна структура. Те контролират синтеза на 9 структурни и 6 регулаторни протеина.
Значението на LTR за вирусния геном е, че те съдържат следните регулаторни елементи, които контролират неговото функциониране:
- транскрипционен сигнал (промоторен регион);
- поли-А добавъчен сигнал;
- сигнал за ограничаване;
- интеграционен сигнал;
- сигнал за положителна регулация (TAR за TAT протеин);
- отрицателен регулаторен елемент (NRE за NEF протеин);
- място за прикрепване на праймерна РНК (tRNA™3) за синтез на минус-верижна ДНК в 3' края; сигнал в 5' края на LTR, който служи като праймер за синтез на плюс-верижна ДНК.
В допълнение, LTR съдържа елементи, участващи в регулирането на сплайсинга на мРНК, опаковането на vRNA молекули в капсида (Psi елемент). Накрая, по време на геномната транскрипция, в дългите мРНК се формират два сигнала за REV протеина, които превключват синтеза на протеини: CAR - за регулаторни протеини и CRS - за структурни протеини. Ако REV протеинът се свърже с CAR, се синтезират структурни протеини; ако той отсъства, се синтезират само регулаторни протеини.
Следните регулаторни гени и техните протеини играят особено важна роля в регулирането на функционирането на вирусния геном:
- TAT протеин, който осъществява положителен контрол върху вирусната репликация и действа чрез TAR регулаторния регион;
- NEV и VPU протеини, които упражняват отрицателен контрол върху репликацията през NRE региона;
- REV протеин, който осъществява положително-отрицателен контрол. REV протеинът контролира работата на гените gag, pol, env и осъществява отрицателна регулация на сплайсинга.
По този начин репликацията на ХИВ е под троен контрол - положителен, отрицателен и положително-отрицателен.
VIF протеинът определя инфекциозността на новосинтезирания вирус. Той е свързан с капсидния протеин p24 и присъства във вириона в количество от 60 молекули. NEF протеинът е представен във вириона от малък брой молекули (5-10), вероятно свързани с обвивката.
VPR протеинът инхибира клетъчния цикъл във фаза G2, участва в транспорта на преинтеграционни комплекси в клетъчното ядро, активира някои вирусни и клетъчни гени и повишава ефективността на вирусната репликация в моноцитите и макрофагите. Местоположението на VPR, TAT, REV и VPU протеините във вириона не е установено.
В допълнение към собствените си протеини, вирионната мембрана може да съдържа някои протеини на клетката гостоприемник. VPU и VPR протеините участват в регулирането на вирусната репродукция.
Антигенни варианти на вируса на човешката имунна недостатъчност (HIV)
Човешкият имунодефицитен вирус (ХИВ) е много вариабилен. Дори от тялото на един пациент могат да бъдат изолирани вирусни щамове, които се различават значително по антигенни свойства. Тази вариабилност се улеснява от интензивното разрушаване на CD4+ клетките и мощния антителен отговор към ХИВ инфекцията. Нова форма на ХИВ, ХИВ-2, биологично близка до ХИВ-1, но имунологично различна от него, е изолирана от пациенти от Западна Африка. Хомологията на първичната структура на геномите на тези вируси е 42%. ДНК провирусът ХИВ-2 съдържа 9671 bp, а неговата LTR - 854 bp. Впоследствие ХИВ-2 е изолиран и в други региони на света. Няма кръстосан имунитет между ХИВ-1 и ХИВ-2. Известни са две големи форми на ХИВ-1: O (Outlier) и M (Major), като последната е разделена на 10 подтипа (AJ). В Русия циркулират осем подтипа (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Механизмът на взаимодействие на HIV с клетката
След като проникне в тялото, вирусът първо атакува клетки, съдържащи специфичния за него CD4 рецептор. Този рецептор присъства в големи количества в Т-хелперите, в по-малки количества в макрофагите и моноцитите, като Т-хелперите са особено чувствителни към вируса.
Човешкият имунодефицитен вирус (ХИВ) разпознава CD4 рецепторите, използвайки своя gpl20 протеин. Процесът на взаимодействие на ХИВ с клетката протича по следната схема: рецептор-медиирана адсорбция -> покрита ямка -> покрита везикула -> лизозома. В него вирионната мембрана се слива с лизозомната мембрана и нуклеокапсидът, освободен от суперкапсида, навлиза в цитоплазмата; по пътя към ядрото той се разрушава и се освобождават геномна РНК и свързаните с нея основни компоненти. След това обратната транскриптаза синтезира минус веригата на ДНК върху вирионната РНК, след което RNase H разрушава вирионната РНК, а вирусната ДНК полимераза синтезира плюс веригата на ДНК. 5'-LTR и 3'-LTR се образуват в краищата на ДНК провируса. ДНК провирусът може да остане в ядрото известно време в неактивна форма, но рано или късно се интегрира в хромозомата на целевата клетка с помощта на своята интеграза. При него провирусът остава неактивен, докато даденият Т-лимфоцит не бъде активиран от микробни антигени или други имунокомпетентни клетки. Активирането на клетъчната ДНК транскрипция се регулира от специален ядрен фактор (NF-kB). Той е ДНК-свързващ протеин и се произвежда в големи количества по време на активирането и пролиферацията на Т-лимфоцитите и моноцитите. Този протеин се свързва с определени последователности на клетъчната ДНК и подобни LTR последователности на ДНК провируса и индуцира транскрипцията както на клетъчната ДНК, така и на ДНК провируса. Чрез индуциране на транскрипцията на ДНК провируса, той осъществява прехода на вируса от неактивно състояние в активно и съответно от персистираща инфекция към продуктивна. Провирусът може да остане в неактивно състояние за много дълго време. Активирането на вируса е критичен момент във взаимодействието му с клетката.
От момента, в който вирусът проникне в клетката, започва периодът на HIV инфекцията - състояние на вирусоносителство, което може да продължи 10 или повече години; и от момента на активиране на вируса започва заболяването - СПИН. С помощта на своите регулаторни гени и техните продукти, вирусът започва активно да се размножава. TAT протеинът може да увеличи скоростта на размножаване на вируса 1000 пъти. Вирусната транскрипция е сложна. Тя включва образуването както на пълнометражна, така и на субгеномна иРНК, сплайсинг на иРНК и след това синтез на структурни и регулаторни протеини.
Синтезът на структурни протеини протича по следния начин. Първо се синтезира прекурсорният полипротеин Pr55Gag (протеин с молекулно тегло 55 kDa). Той съдържа 4 основни домена: матричен (MA), капсиден (CA), нуклеокапсиден (NC) и rb домейн, от който, в резултат на отрязване на Pr55Gag от вирусната протеаза (той се самоотрязва от друг прекурсорен протеин, Gag-Pol), се образуват съответно структурните протеини p17, p24, p7 и rb. Образуването на полипротеина Pr55Gag е основното условие за образуването на вирусни частици. Именно този протеин определя програмата за морфогенеза на вириона. Тя последователно включва етапите на транспортиране на Gag полипротеина до плазмената мембрана, взаимодействие с нея и протеин-протеинови взаимодействия по време на образуването на вирусната частица и нейното пъпкуване. Pr55Gag се синтезира върху свободни полирибозоми; протеиновите молекули се транспортират до мембраната, където се закрепват чрез своите хидрофобни области. CA домейнът играе основна роля в създаването на нативната конформация на Gag протеина. NC домейнът осигурява включването (с помощта на своите „цинкови пръсти“) на 2 молекули геномна РНК в състава на образуващата се вирусна частица. Молекулата на полипротеина първоначално димеризира поради взаимодействието на матричните домейни. След това димерите се комбинират в хексамерни (от 6 единици) комплекси в резултат на взаимодействието на CA и NC домейните. Накрая хексамерите, съединявайки се по страничните си повърхности, образуват незрели сферични вириони, вътре в които се съдържа геномната вирусна РНК, уловена от NC домейна.
Друг прекурсорен протеин, Prl60Gag-Pol (протеин с молекулно тегло 160 kDa), се синтезира в резултат на изместване на рамката на четене от рибозомата по време на транслацията на 3'-края на gag гена в областта, разположена непосредствено преди областта, кодираща rb протеина. Този Gag-Pol полипротеин съдържа непълна Gag протеинова последователност (1-423 аминокиселини) и Pol последователности, които включват PR, RT и IN домейните. Молекулите на Gag-Pol полипротеините също се синтезират върху свободни полирибозоми и се транспортират до плазмената мембрана. Полипротеинът Prl60Gagpol съдържа всички места за междумолекулно взаимодействие и места за свързване с мембраната, присъщи на Gag полипротеина. Следователно, молекулите на Gag-Pol полипротеините се сливат с мембраната и заедно с Gag молекулите се включват във формиращите се вириони, което води до появата на активна протеаза и началото на процеса на зреене на вириона. HIV-1 протеазата е силно активна само под формата на димер, следователно за нейното самоизрязване от Prl60Gag-Pol е необходима димеризация на тези молекули. Съзряването на вириона се състои в това, че освободената активна протеаза разрязва prl60Gag-Pol и Gag55 в местата, разпознати от нея; образуват се протеини p17, p24, p7, p6, ревертаза, интеграза и се осъществява тяхното свързване във вирусната структура.
Протеинът Env се синтезира върху рибозоми, свързани с мембраните на ендоплазмения ретикулум, след което се гликозилира, разрязва се от клетъчна протеаза на gp120 и gp41 и се транспортира до клетъчната повърхност. В този случай gp41 прониква през мембраната и се свързва с матричните домейни на протеиновата молекула Gag, свързани с вътрешната повърхност на мембраната. Тази връзка се запазва и в зрелия вирион.
По този начин, сглобяването на вирусните частици се състои от агрегиране на прекурсорни протеини и свързани с тях РНК молекули върху плазмената мембрана на клетката гостоприемник, образуване на незрели вириони и тяхното освобождаване чрез пъпкуване от клетъчната повърхност. По време на пъпкуването вирионът се обгражда с клетъчна мембрана, в която са вградени молекулите gp41 и gp120. По време на пъпкуването или евентуално след освобождаването на вирионите настъпва тяхното съзряване, което се осъществява с помощта на вирусна протеаза и се състои в протеолитично разрязване на прекурсорните протеини Pr55Gag и Prl60Gag-Pol в протеини на зрелия вирус и тяхното свързване в определени структурни комплекси. Водеща роля в процесите на вирусна морфогенеза играе прекурсорният полипротеин Pr55Gag, който организира и сглобява незрелия вирион; процесът на неговото съзряване се завършва от специфична вирусна протеаза.
Причини за имунодефицит
Една от основните причини за имунодефицит при HIV инфекция е масовата смърт на Т-хелпери. Тя възниква в резултат на следните събития. Първо, Т-хелперите, заразени с вируса, умират поради апоптоза. Смята се, че при пациенти със СПИН вирусната репликация, апоптозата и намаляването на броя на Т-хелперите са взаимосвързани. Второ, Т-килърите разпознават и унищожават Т-клетки, заразени с вируса или носещи адсорбирани молекули gpl20, както и заразени с вируса и незаразени с вируса Т-хелпери, които образуват симпласти (синцитиум), състоящи се от няколко десетки клетки (някои от тях умират в резултат на размножаването на вируси в тях). В резултат на унищожаването на голям брой Т-хелпери се наблюдава намаляване на експресията на мембранните рецептори в В-лимфоцитите към интерлевкин-2, нарушава се синтезът на различни интерлевкини (растежни фактори и диференциация на В-лимфоцитите - IL-4, IL-5, IL-6 и др.), което води до нарушаване на функцията на Т-килърите. Активността на комплементната и макрофагната система е потисната. Макрофагите и моноцитите, заразени с вируса, не умират дълго време, но не са в състояние да отстранят вируса от организма. Накрая, поради структурното и антигенно сходство на gpl20 с рецепторите на някои епителни клетки на тялото (включително трофобластните рецептори, медииращи трансплантационното предаване на HIV), се синтезират антирецепторни антитела с широк спектър на действие. Такива антитела са способни да блокират различни клетъчни рецептори и да усложняват протичането на заболяването с автоимунни нарушения. Последицата от HIV инфекцията е поражението на всички основни звена на имунната система. Такива пациенти стават беззащитни срещу голямо разнообразие от микроорганизми. Това води до развитие на опортюнистични инфекции и тумори. При пациенти с HIV инфекция се увеличава рискът от развитие на поне три вида рак: сарком на Капоши; карцином (включително рак на кожата); B-клетъчен лимфом, който възниква поради злокачествена трансформация на B-лимфоцитите. HIV обаче е не само лимфоцитотропен, но и невротропен. Той прониква в клетките на централната нервна система (астроцитите) както чрез рецепторно-медиирана ендоцитоза, така и чрез фагоцитоза на заразени с вируса лимфобласти от астроцити. При взаимодействие на вируса с астроцитите се образуват и симпласти, които улесняват разпространението на патогена през междуклетъчните канали. Вирусът може да персистира дълго време в макрофагите и моноцитите, така че те служат като резервоар и дистрибутори на него в организма, като са способни да проникнат във всички тъкани. Заразените макрофаги играят основна роля за въвеждането на HIV в централната нервна система и нейното увреждане. При 10% от пациентите първичните клинични синдроми са свързани с увреждане на централната нервна система и се проявяват като деменция. По този начин, хората, заразени с HIV, се характеризират с 3 групи заболявания - опортюнистични инфекции,туморни заболявания и увреждане на централната нервна система.
Епидемиология на ХИВ инфекцията
Източник на ХИВ инфекция е само човек - болен или вирусоносител. Вирусът на човешката имунна недостатъчност (ХИВ) се съдържа в кръвта, спермата, цервикалната течност; при кърмещи майки - в кърмата. Заразяването става по полов път, чрез кръв и нейните препарати, както и от майка на дете преди, по време и след раждане. Не са известни случаи на заразяване с вируса чрез храна, напитки и ухапвания от насекоми.
Наркоманията допринася за разпространението на СПИН. Честотата на ХИВ нараства всяка година. Според СЗО, от 1980 до 2000 г. 58 милиона души са били заразени с ХИВ. Само през 2000 г. 5,3 милиона души са били заразени по целия свят, а 3 милиона души са починали от СПИН. Към 1 януари 2004 г. в Русия са регистрирани 264 хиляди ХИВ-инфектирани. Половината от заразените с ХИВ умират в рамките на 11-12 години от момента на заразяване. В началото на 2004 г. от всеки 100 хиляди граждани на Русия около 180 живеят с диагноза „ХИВ инфекция“. Прогнозира се, че при това ниво на заболеваемост общият брой на ХИВ-инфектираните в Русия до 2012 г. ще бъде 2,5-3 милиона души. Сложността на борбата с ХИВ инфекцията зависи от редица причини: първо, няма ефективни методи за нейното лечение и специфична превенция; второ, инкубационният период за ХИВ инфекция може да надхвърли 10 години. Продължителността му зависи от момента на активиране на Т-лимфоцита и ДНК провируса, съдържащ се в неговата хромозома. Все още не е ясно дали всеки, заразен с вируса, е обречен на СПИН или е възможно дългосрочно носителство на вируса без заболяване (което изглежда малко вероятно). И накрая, съществуват няколко вируса на човешката имунна недостатъчност (HIV-1, HIV-2), антигенните разлики между които предотвратяват образуването на кръстосан имунитет. Откриването на маймунския имунодефицитен вирус (SIV) хвърли светлина върху въпроса за произхода на HIV. SIV е подобен на HIV по организацията на генома си, но се различава значително по нуклеотидната си последователност. HIV-2 заема междинно положение между HIV-1 и SIV по серологични свойства и е по-близък до SIV по нуклеотидна последователност. В тази връзка В. М. Жданов предположи, че вирусите HIV-1, HIV-2 и SIV произхождат от общ прародител. Според Р. Гало е възможно един от SIV-овете по някакъв начин да е попаднал в човешкото тяло, където е претърпял серия от мутации, довели до появата на HIV-1, HIV-2 и другите му форми.
Симптоми на ХИВ инфекция
Вирусът на човешката имунна недостатъчност има някои характеристики, които до голяма степен определят патогенезата на заболяването. Вирусът има много висока скорост на размножаване, определена от неговите регулаторни елементи (в активен стадий се синтезират до 5000 вириона за 5 минути). Поради наличието на фузионния протеин (gp41), вирусът индуцира образуването на обширни синцитиални структури, дължащи се на сливането на инфектирани и неинфектирани Т-хелпери, което води до тяхната масова смърт. Образуваните в големи количества протеинови молекули gpl20 свободно циркулират в кръвта и се свързват с рецепторите на неинфектираните Т-хелпери, в резултат на което те също се разпознават и унищожават от Т-килърите. Вирусът може да се разпространява по междуклетъчни канали от клетка в клетка, като в този случай става труднодостъпен за антителата.
Клинични критерии за ХИВ инфекция
При възрастни, ХИВ инфекцията се диагностицира, когато имат поне два сериозни симптома в комбинация с поне един незначителен симптом и при липса на други известни причини за имунодефицит (рак, вроден имунодефицит, тежко гладуване и др.). Сериозните симптоми включват:
- загуба на тегло от 10% или повече;
- продължително фебрилно състояние, периодично или постоянно;
- хронична диария.
Незначителни симптоми: упорита кашлица, генерализиран дерматит, рецидивиращ херпес зостер, орална и фарингеална кандидоза, хроничен херпес симплекс, генерализирана лимфаденопатия. Диагнозата СПИН се поставя при наличие само на сарком на Капоши, криптококов менингит, пневмоцистна пневмония. Клиничната картина на заболяването се влияе от съпътстващата опортюнистична инфекция.
Методи за култивиране на вируса на човешката имунна недостатъчност (HIV)
HIV-1 и HIV-2 могат да се култивират в клетки само на един клон от TCV4 лимфоцити - H9, получен от левкемични TCV4 лимфоцити. За тези цели могат да се използват и монослойни култури от астроцитни клетки, в които HIV-1 се размножава добре. Шимпанзетата са податливи на HIV-1 сред животните.
Устойчивостта на вируса във външната среда е ниска. Той умира под въздействието на слънчева светлина и UV радиация, унищожава се при 80°C в рамките на 30 минути, а при третиране с често използвани дезинфектанти - в рамките на 20-30 минути. За дезинфекция на материал, съдържащ вируси, е необходимо да се използват микобактерицидни дезинфектанти, тъй като те са ефективни срещу микроорганизми с най-висока резистентност.
Лабораторна диагностика на HIV инфекцията
Основният метод за диагностициране на вирусоносителство и HIV инфекция е ензимният имуноанализ. Въпреки това, поради факта, че gpl20 има структурно и антигенно сходство с рецепторите на някои човешки клетки, включително рецептори, които транспортират имуноглобулини през епителните клетки на лигавиците, в организма могат да се появят антитела, свързани с антитела срещу gpl20. В този случай може да има фалшиво положителни резултати от ELISA. Следователно, всички положително реагиращи серуми на изследваните лица се подлагат на допълнителен анализ, използвайки метода на имуноблотинг или Western blotting. Този метод се основава на идентифицирането на изследваните антитела след тяхното електрофоретично разделяне и последващо тестване с помощта на маркирани антивидови антитела. Вирусологичният метод се използва рядко поради сложността на култивирането на вируса. Клонът на H9 лимфоцитите се използва за получаване на вирусни антигени - необходимите компоненти на диагностичните тестови системи. CPR методът позволява откриване на вируса в ранен стадий на виремия.
Лечение на ХИВ инфекция
Необходимо е да се намерят или синтезират лекарства, които ефективно потискат активността на обратната транскриптаза (ревертаза) или вирусната протеаза. Те биха предотвратили образуването на ДНК провирус и/или биха инхибирали вътреклетъчното размножаване на вируса. Съвременната стратегия за лечение на HIV-инфектирани пациенти се основава на принципа на комбинирано приложение на лекарства, които инхибират вирусната протеаза (едно от лекарствата) и обратната протеаза (2 различни лекарства) - комбинирана (тройна) терапия. В Русия за лечение на HIV-инфектирани пациенти се препоръчва комбинираното приложение на 2 местни лекарства: фосфазид и криксиван, които специфично потискат репродукцията на HIV в ранните и късните етапи на репродукция, особено при намалена активност на азидотимидин.
Проблемът на специфичната профилактика е необходимостта от създаване на ваксина, която да осигури формирането на ефективен клетъчно-медииран имунитет, базиран на вирус-специфични цитотоксични лимфоцити, без значително производство на антитела. Такъв имунитет се осигурява от Thl помощници. Възможно е антителата, включително вирус-неутрализиращите, да са не само неефективни при потискане на HIV инфекцията, но и във висока степен да потискат клетъчно-медиирания имунитет. Следователно, ваксината срещу HIV трябва да отговаря, на първо място, на две основни изисквания: а) да бъде абсолютно безопасна и б) да стимулира активността на T-цитотоксичните лимфоцити. Изследва се ефективността на различни варианти на ваксината, получени от убити (инактивирани) вируси и от отделни антигени с високи защитни свойства. Такива антигени могат да бъдат или изолирани от самите вириони, или синтезирани химически. Предложена е ваксина, създадена въз основа на методи на генно инженерство. Тя представлява рекомбинантен вирус на ваксината, носещ HIV гени, отговорни за синтеза на антигени със силни имуногенни свойства. Въпросът за ефективността на тези ваксини изисква значително време поради дългия инкубационен период на HIV инфекцията и високата вариабилност на патогена. Създаването на високоефективна ваксина срещу HIV е спешен фундаментален проблем.

