Медицински експерт на статията
Нови публикации
Роля на промените в субхондралната кост в патогенезата на остеоартрита
Последно прегледани: 04.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
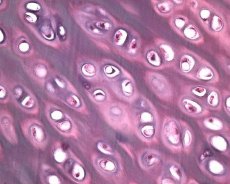
Наред с дегенерацията на ставния хрущял, подлежащата костна тъкан също участва в патологичния процес при остеоартроза. Предполага се, че удебеляването на субхондралната пластина допринася за прогресията на остеоартрозата. С напредването на остеоартрозата, ставният хрущял, който е подложен на механично и химическо натоварване, бавно ерозира поради дисбаланс в процесите на катаболизъм и репарация на хрущяла. По-специално, механичното натоварване във връзка със ставите, „носещи“ телесното тегло, допринася за образуването на голям брой микрофрактури в субхондралната пластина и хрущяла. С ерозията на ставния хрущял, склерозата на субхондралната кост прогресира, ригидността на костната тъкан се увеличава, което от своя страна допринася за по-нататъшно нарушаване на структурата на ставния хрущял. Въпросът за първичния или вторичния характер на промените в субхондралната кост при остеоартроза обаче остава нерешен.
Доскоро рентгенографски откриваемите промени в гъбестото вещество на субхондралната кост, като склероза или образуване на кисти, се считаха за вторични при пациенти с остеоартроза. Резултатите от клинични и експериментални изследвания обаче показват възможна инициираща роля на субхондралната кост в патогенезата на остеоартрозата. Един от възможните механизми е рязкото повишаване на градиента на твърдост на субхондралната кост поради факта, че целостта на подлежащата хрущялна тъкан зависи от механичните свойства на костното ѝ „легло“. Проучвания върху примати показват, че промените в субхондралната кост могат да предшестват промените в ставния хрущял. Доказателствата за и против тази хипотеза, появили се в резултат на изследвания върху животински модели на остеоартроза и клинични изследвания, само засилиха дебата. Удебеляването на трабекулите в субхондралната кост не винаги е съпроводено с повишаване на костната минерализация или по-скоро с увеличаване на обема на остеоида. Този признак на анормална минерализация показва, че нарушението на регулацията на костното ремоделиране е неразделна част от остеоартрита и също така подкрепя концепцията за дефект на костните клетки при остеоартрит. Групата на J. Dequeker (1989) счита последното за „генерализирано метаболитно костно заболяване“.
Костната тъкан се обновява постоянно. Този динамичен процес, наречен костно ремоделиране, е сложна последователност от резорбция и минерализация. Остеокластите резорбират костната тъкан, а остеобластите секретират протеини, които формират основния органичен компонент за минерализация. Образуването и резорбцията на костите не се случват произволно в целия скелет; това е програмиран процес, който протича в различни области на скелета, наречени единици за костно ремоделиране. В началото на цикъла остеокластите се появяват върху неактивната повърхност; в рамките на 2 седмици те образуват тунел в кортикалната кост или лакуна върху повърхността на трабекуларната кост. Честотата на активиране на нови единици за костно ремоделиране определя степента на костно обновяване. При здрав млад човек процесите на костно образуване и резорбция са балансирани и се поддържа нормална костна маса. В хормоналната регулация на резорбцията на костната тъкан, поне PTH и PGE2 , участват не само остеокластите, но и остеобластите, тъй като под влиянието на тези хормони се освобождават фактори, стимулиращи костната резорбция от остеокластите. В момента са известни повече от 12 локални и системни регулатора на растежа на костната тъкан, които влияят на нейното ремоделиране, по-специално PTH, 1,25(OH)2D3 ,калцитонин, растежен хормон, глюкокортикоиди, тироидни хормони, инсулин, IGF (1 и 2), естрогени, PGE2 , андрогени.
Костните клетки освобождават редица протеини и цитокини, които извършват ендокринна регулация и сигнална трансдукция. Протеините, произвеждани от остеобластите, включват протеини на костния матрикс, като колаген, остеопонтин, остеокалцин, костни сиалопротеини. Освен това, тези клетки освобождават протеази както в активна, така и в латентна форма, които участват в процеса на ремоделиране на костната тъкан - MMPs, компоненти на системата плазминогенен активатор (PA)/плазмин. Цитокините, освобождавани от остеобластите, могат да действат както чрез автокринни механизми, така и чрез паракринни пътища върху локални клетки (други остеобласти, остеокласти).
Все още не е известно дали тези сигнали се регулират от механично напрежение или други химични сигнали, индуцирани от механично напрежение. Известно е обаче, че повтарящото се механично напрежение причинява локална пролиферация на костни клетки и/или протеини. In vivo, механичното натоварване може да активира остеобластите, да увеличи нивото на циклични нуклеотиди, производството на простагландини и да причини морфологични промени, свързани с костното ремоделиране. In vitro, механичното напрежение причинява пролиферация на остеобластни култури, експресия на иРНК на костни протеини, участващи в образуването и минерализацията на остеоиди, освобождаване на локални растежни фактори като IGF-1 и IGF-2 и адхезионни молекули. Предаването на сигнала за механично напрежение може да се осъществи чрез механочувствителни йонни канали.
Има косвени доказателства за дисфункция на остеобластите при остеоартроза. G. Gevers и J. Dequeker (1987) демонстрират повишаване на серумните нива на остеокалцин при жени с остеоартроза на ръката, както и в кортикални костни експлантати, което показва, че костната патология може да е част от остеоартрозата. Аутопсията разкрива не само удебеляване на субхондралната кост, но и анормално ниска минерализация на главата на бедрената кост. При морски свинчета с хирургично индуцирана остеоартроза компютърната томография разкрива значително удебеляване на костната фракция в субхондралната зона. Дисбалансът между колагеновите и неколагеновите (остеокалцин и др.) протеини може да доведе до увеличаване на костния обем, но не влияе на минералната ѝ плътност. Според M. Shimizu et al. (1993), прогресията на дегенеративните промени в ставния хрущял е свързана с по-интензивно ремоделиране на субхондралната кост и повишаване на нейната ригидност, което също показва дефект в клетките на костната тъкан при остеоартроза. Според хипотезата, предложена от Б. Лий и М. Аспдън (1997), пролиферацията на дефектни костни клетки може да доведе до повишаване на твърдостта на костната тъкан, но не причинява повишаване на нейната минерална плътност.
CI Westacott et al. (1997) предполагат, че анормалните остеобласти пряко влияят върху метаболизма на хрущяла. Култивирайки остеобласти от пациенти с остеоартрит с хондроцити от хора, които не са имали ставни заболявания, авторите наблюдават значителна промяна в освобождаването на гликозаминогликани от нормалната хрущялна тъкан in vitro, но нивото на освобождаване на цитокини остава непроменено. G. Hilal et al. (1998) показват, че културата на остеобласти от субхондрална кост на пациенти с остеоартрит in vitro има променен метаболизъм - активността на AP/плазмин системата и нивото на IGF-1 в тези клетки са повишени. Наблюдението на CI Westacott et al. (1997) може да се обясни с повишаване на активността на протеазите в субхондралните костни клетки.
Остава неизвестно дали промените в субхондралната кост инициират остеоартрит или допринасят за неговата прогресия. DK Dedrick et al. (1993) демонстрират, че при кучета с хирургично индуциран остеоартрит, удебеляването на субхондралната кост не е необходимо условие за развитие на остеоартрозоподобни промени в ставния хрущял, но допринася за прогресията на дегенеративните процеси в хрущяла. Резултатите от изследването на A. Sa'ied et al. (1997) противоречат на данните от предишното изследване. Използвайки 50 MHz ехография за оценка на началните морфологични промени и тяхната прогресия в ставния хрущял и костта при експериментален остеоартрит, индуциран от инжекции с монойодоцетна киселина в коленната става на плъхове, авторите демонстрират едновременен процес на промени в костта и хрущяла през първите три дни след инжектирането.
Остеобластите секретират растежни фактори и цитокини, участващи в локалното костно ремоделиране, което може да насърчи ремоделирането на собствения хрущял в „носещите тежест“ стави след проникването им през микропукнатини в калцифицирания слой на ставния хрущял. Освен това, секреторни продукти на костните клетки се откриват в синовиалната течност. Най-вероятните продукти, секретирани от анормални остеобласти, които могат да инициират процеса на локално хрущялно ремоделиране, са TGF-β и костните морфометрични протеини (BMP). И двата члена на семейството TGF се секретират както от хондроцити, така и от остеобласти и са способни да модифицират както костното, така и хрущялното ремоделиране. J. Martel Pelletier et al. (1997) наблюдават повишаване на нивото на TGF-β в субхондрални костни експлантати на пациенти с остеоартроза в сравнение със здрави индивиди, което показва вероятна роля на този растежен фактор в патогенезата на остеоартрозата. IGF също се произвеждат от остеобласти. В култура от остеобластоподобни клетки, получени от пациенти с остеоартроза, е установено повишаване на нивото на IGF, които променят метаболизма на хрущяла.
TGF-b, IGF, BMP и цитокините, продуцирани от остеобластите в субхондралната кост, могат да повлияят на производството на колагеназа и други протеолитични ензими в хрущяла, което от своя страна може да насърчи ремоделирането/разграждането на хрущялната матрица. Остава неясно дали остеобластите при остеоартрит произвеждат по-малко макрофагов колонистимулиращ фактор (M-CSF - стимулатор на костната резорбция) от нормалните клетки. Резултатите от проучвания на AG Uitterlinden et al. (1997) показват, че рецепторите за витамин D, които се експресират от остеобластите и регулират експресията на редица фактори, синтезирани от тези клетки, могат да играят определена роля в образуването на остеофити, което частично обяснява ролята на остеобластите в патогенезата на това заболяване.
Вземайки предвид резултатите от горепосочените изследвания, G. Hilal et al. (1998), J. Martel-Pelletier et al. (1997) предлагат следната работна хипотеза за връзката между ремоделирането на субхондралната кост и собствения ставен хрущял при остеоартроза. В ранен или напреднал стадий на патогенезата на остеоартрит, процесът на ремоделиране на костната тъкан в субхондралната кост се засилва. Едновременно с това, многократното натоварване води до локални микрофрактури и/или поява на дисбаланс в системата IGF/IGF-свързващ протеин (IGFBP) поради анормален отговор на остеобластите на субхондралната кост, което допринася за нейната склероза. Последното от своя страна може да допринесе за появата на микрофрактури на собствения хрущял и увреждане на неговата матрица.
При нормални условия, това увреждане се възстановява чрез локален синтез и освобождаване на IGF-1 и IGF-свързващ протеин, които стимулират образуването на ECM на ставния хрущял. В същото време, GF-системата насърчава растежа на субхондралните костни клетки и образуването на костна матрица. Анаболната активност на IGF-системата се повишава в субхондралната кост на пациенти с остеоартроза, докато локалното активиране на AP/плазмин системата (локален регулатор на IGF-системата) в ставния хрущял причинява неговите локални промени. В остеобластите при остеоартроза, IGF-1 нарушава регулацията на AP от плазмина чрез типа на положителната обратна връзка, следователно може да ограничи ремоделирането в костната тъкан, което в крайна сметка води до субхондрална склероза. По този начин, в костната и хрущялната тъкан, локалната индукция на IGF-1 и протеази води, от една страна, до увреждане на хрущяла, а от друга страна, до удебеляване на субхондралната кост, което от своя страна допринася за по-нататъшно увреждане на хрущяла. Дисбалансът между увреждането на хрущяла, свързано със субхондрална склероза, и неговите репаративни възможности води до прогресивни промени в хрущялния извънклетъчен матрикс (ECM) и до развитие на остеоартроза. Според авторите, тази хипотеза обяснява и бавното прогресиране на заболяването.

