Медицински експерт на статията
Нови публикации
Медикаменти
Лекарства за предотвратяване на тромбоза и подобряване на реологията на кръвта
Последно прегледани: 07.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
За предотвратяване на образуването на множество микротромби по време на шок и тяхното разрушаване могат да се използват различни фармакологични подходи, които използват лекарства, предотвратяващи образуването на тромби и подобряващи реологията на кръвта:
- елиминиране на системни хемодинамични и микроциркулационни нарушения с помощта на вазоактивни и инотропни средства;
- мерки за подобряване на реологията на кръвта с помощта на рационална инфузионна терапия и лекарства, които възстановяват еластичността на еритроцитните мембрани (трентал или пентоксифилин);
- предотвратяване на тромбоцитната агрегация и образуването на първоначални „бели“ тромби в малки артериални съдове с последващо иницииране на коагулационната каскада;
- инхибиране на образуването на тромби след активиране на системната коагулационна каскада;
- активиране на фибринолизата с цел разтваряне на новообразувани кръвни съсиреци (фибринолизин, стрептокиназа, стрептодеказа, урокиназа и др.) или, напротив, инхибиране на фибринолизата, когато тя е генерализирана при някои пациенти с травматичен шок и сепсис (аминокапронова киселина, амбен, контрикал и др.).
Повечето от изброените подходи са традиционни, добре развити в практиката на лечение на шок, имат свои собствени хеморологични показания и са посочени в съответните глави. Ето защо в този раздел е препоръчително да се спрем на разглеждането на общия подход за предотвратяване на образуването на тромби при шок с помощта на фармакологични средства, които повлияват профазата на кръвосъсирването. Именно това ниво на предотвратяване на коагулационни усложнения - появата, образуването и растежът на „бели артериални тромби“ - привлича най-голямото внимание на изследователите.
Различни и често многопосочни нарушения на кръвосъсирването с влошаване на реологията му са характерни за различните видове шок. Най-характерното за септичния, ендотоксиновия, изгарящия, травматичния и хеморагичния видове шок е образуването на множество микротромби в най-малките съдове, причинени от нарушения на системната хемодинамика, вазоспазъм и нарушения на микроциркулацията, сгъстяване на кръвта, утайка, намалена еластичност на еритроцитните мембрани, както и множество общи и локални фактори (автокоиди), иницииращи локални промени в коагулационната хемостаза и включването на профазата на кръвосъсирването.
В схематичен (съкратен) вид, началният етап на хемокоагулация и механизмът на локална хемокоагулационна хомеостаза са представени по следния начин.
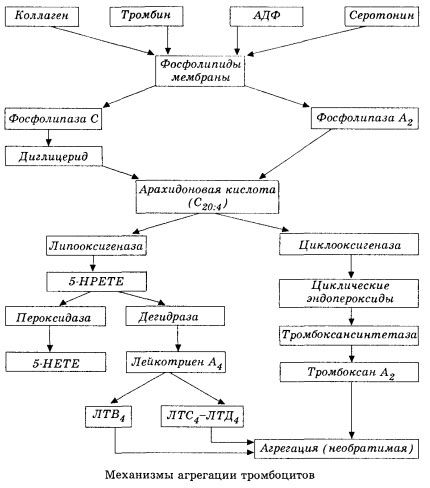
Започва с активиране на мембранната фосфолипаза А2 в резултат на въздействието на комбинация от увреждащи фактори (директно увреждане на мембраната, хипоксия, липидна пероксидация, въздействие на ендогенни химични фактори и др.). В резултат на разграждането на мембранните фосфолипиди се освобождават неестерифицирани дълговерижни мастни киселини, от които арахидоновата киселина е най-важна като изходен субстрат. Нейната трансформация (каскада на арахидонова киселина) се осъществява чрез липоксигеназния (синтез на левкотриени) и циклооксигеназния (синтез на простагландини, тромбоксани, простациклин) пътища.
Получените левкотриени (B4, C4, E4, D4 и др.) - вещества с изключително висока биологична активност, към които принадлежи и бавно реагиращото вещество на анафилаксията - имат голямо значение за инициирането на локални съдови, възпалителни и имунни реакции, включително автоимунни процеси. Левкотриените причиняват нарушения на микроциркулацията, повишено кръвосъсирване, освобождаване на автолитични лизозомни ензими и отделяне в кръвта на фактор, който инхибира миокардната контрактилност и бронхиалния спазъм.
Поради способността си да предизвикват свиване на гладката мускулатура, левкотриените оказват значително влияние върху системната хемодинамика, коронарните съдове и миокарда, упражнявайки мощен коронарен констрикторен и отрицателен инотропен ефект, който е съпроводен с намаляване на сърдечния дебит и играе важна роля в развитието на хипотония.
Намаленият сърдечен дебит и хипотензивният отговор към левкотриени са свързани с отслабване на сърдечния мускул и ограничаване на венозното връщане към сърцето. От съществено значение за ограничаване на венозното връщане е способността на левкотриените да увеличават пропускливостта на съдовата стена и да причиняват екстравазация на плазмата. Левкотриените се считат за важни в патогенезата на миокардния инфаркт.
При анафилактичен и септичен (ендотоксинов) шок тяхната роля очевидно се увеличава още повече, както се вижда от способността на левкотриените да се натрупват в значителни количества в плазмата по време на алергични реакции и да причиняват промени в системния кръвен поток, характерни за анафилактичен шок, както и защитните ефекти на блокерите на левкотриеновите рецептори и инхибиторите на липоксигеназата. Разработването на селективни блокери на левкотриеновите рецептори се извършва доста интензивно и е обещаващо направление в науката. В тази област вече са постигнати известни успехи и ефективността на такива блокери при миокардна исхемия, ендотоксинов и хеморагичен шок е експериментално потвърдена. Вероятно обаче ще са необходими още няколко години, преди това направление да бъде приложено клинично.
Ако във венозните съдове тромбите се образуват с равно участие на тромбоцити и плазмени коагулационни фактори, то в артериите тромбоцитите са основните инициатори на процеса. Те съдържат ADP, Ca2+, серотонин, фосфолипиди, ензими за синтез на простагландин и тромбоксан, тромбостенин (подобно на мускулния актомиозин, осигурява контрактилната способност на тези клетки), тромбогенен растежен фактор на епитела и мускулните клетки на съдовата стена и редица други вещества. Хуморалната регулация на функциите на тромбоцитите се осъществява чрез специализирани рецептори на техните мембрани (алфа2- и бета2-адренорецептори, рецептори за хистамин и серотонин, ацетилхолин, тромбоксан, аденозин и редица други). Специално свойство на тромбоцитите е високият афинитет към колаген и други субендотелни елементи на съдовата стена, към немокрящи се и отрицателно заредени повърхности. Това свойство осигурява на тромбоцитите изключителна способност да се прилепват (залепват) към участък от съд с увреден ендотел, който има голяма възможност да бъде увреден по време на шок. В този случай тромбоцитите се разпръскват и освобождават псевдоподии, които могат да се прилепват една към друга и към стената на съда. Пропускливостта на мембраната се увеличава и от тромбоцитите се освобождават адсорбирани върху повърхността на тромбоцита АДФ, серотонин, тромбоксан и някои коагулационни фактори. Тези вещества взаимодействат със съответните рецептори на мембраната и с участието на калциеви йони причиняват агрегация (първоначално обратима). Процесът става самоподдържащ се, което се улеснява от хуморални регулаторни фактори; други фактори, напротив, могат да го спрат и дори да го обърнат, причинявайки дезагрегация.
С преобладаването на тромбообразуващи влияния и условия, фазите на адхезия и обратима агрегация се заменят от третата фаза - необратима агрегация, която се осъществява с участието на тромбостенин и води до свиване на съсирека; реакцията на укрепване на агреганта и свиване също протича с участието на Ca+, ATP и води до образуването на бял тромб.
Циклооксигеназният път на превръщане на арахидонова киселина в тромбоцитите, съдовите ендотелни клетки и други тъкани осигурява локална (полуживотът на метаболитите е много кратък) коагулационна хомеостаза, тъй като по време на този метаболизъм се образуват мощни про- и антиагрегантни вещества. Основният фактор, активиращ тромбоцитната агрегация във веригата от циклооксигеназни реакции, е тромбоксан А2, а неговият не по-малко мощен антагонист е простациклинът, произвеждан от ендотелни клетки и в по-малка степен от простагландини от серията E и G. Накрая, тромбоцитната агрегация е силно повлияна от допълнителни локални и системни хуморални фактори.
Активатори и инхибитори на агрегацията на тромбоцитите
Инициатори и активатори на тромбоцитната агрегация |
Инхибитори на тромбоцитната агрегация |
Колаген |
- |
АДФ |
Аденозин и неговите стабилизатори |
Норепинефрин (чрез алфа2 рецептори) |
Алфа-адренергични блокери |
Серотонин |
Антисеротонинови средства |
Хистамин |
Антихистамини |
Тромбин |
Хепарин |
Са2+ |
Са2+ антагонисти |
CGMP - неговите индуктори (ацетилхолин?) и стабилизатори |
CAM - нейните индуктори (чрез бета-адренергични рецептори) и стабилизатори (инхибитори на фосфодиестеразата) |
Арахидонова киселина |
Декстрани, албумин |
Тромбоксан А2 |
Простациклин I2 |
Фармакологичните интервенции в началната фаза на образуване на тромби при шок и остри исхемични процеси в сърцето и мозъка предполагат следната възможност:
- инхибиране на началните реакции (пълни и частични) на каскадата на арахидоновата киселина;
- инхибиране на определена реакция на синтеза на тромбоксан;
- блокиране на рецепторите за левкотриени и тромбоксани в тромбоцитите, гладките мускули и други клетки;
- използването на вещества, които модулират тромбоцитната агрегация, т.е. отслабват по други начини реакцията на последните към влиянието на иницииращи фактори (колаген, тромбоксан А2, левкотриени и др.).
Прилагането на изброените начини за коригиране на нарушенията на реологичните свойства на кръвта осигурява решаването на основната тактическа задача: да се защитят рецепторите за агрегация и адхезия на тромбоцитите от ефекта на активаторите или да се потиснат вътреклетъчните механизми на синтез на тези рецептори. Инхибирането на началните реакции на каскадата на арахидоновата киселина може да се постигне чрез защита на тромбоцитните рецептори, които реагират на полимерни активатори, с помощта на нискомолекулни декстрани, чиито молекули се конкурират с фибрин, колаген, агрегиран имуноглобулин (IgE) и компоненти на комплементната система.
Чрез маскиране на рецепторите върху тромбоцитната мембрана и конкуриране с едродисперсните протеини на повърхността на еритроцитите, нискомолекулните декстрани ги изместват и разрушават мостовете между клетките. Това се дължи на факта, че декстраните, обгръщайки съдовия ендотел и повърхността на кръвните клетъчни елементи, увеличават отрицателния им заряд, като по този начин засилват антиагрегационните свойства.
Декстран
Нискомолекулните декстрани намаляват индуцираната от колаген и АДФ тромбоцитна агрегация, както и активиращия ефект на тромбина върху тромбоцитите, инхибират растежа на първоначалния бял тромбоцитен тромб, подобряват кръвния поток, намаляват постоперативното увеличение на плазменото съдържание на фибриноген и променят структурата и стабилността на фибрина.
Венозните инфузии на декстрани при травма и шок не само намаляват агрегацията и адхезията на тромбоцитите, но и мобилизират ендогенния хепарин, като по този начин насърчават образуването на рохкав и трудно прибираем кръвен съсирек, който лесно се лизира от фибринолитици. Антитромбиновата активност на нискомолекулните декстрани е свързана с техния специфичен ефект върху структурата и функцията на фактор на кръвосъсирването VIII. Фактор VIII (антихемофилен глобулин), голяма молекула със сложна структура и функция, участва в агрегацията на тромбоцитите и стабилността на получения съсирек. Декстраните пречат на действието на фактор VIII, като по този начин забавят агрегацията на тромбоцитите и намаляват стабилността на съсирека.
Нискомолекулните декстрани не са истински антикоагуланти и коригиращият им ефект при хеморологични нарушения е свързан главно с хемодилуция, попълване на обема на циркулиращата плазма и подобряване на кръвния поток в микроциркулационната система.
Способността на декстраните да подобряват кръвния поток при хемодинамични нарушения (шок, кръвозагуба) се дължи на комплекс от фактори. Появата на висока преходна концентрация на полимера в кръвта не само води до „директна хемодилуция“, но и създава условия за навлизане на течност в кръвния поток от интерстициалното пространство и последващо балансиране на осмотичния ефект на декстрана. Вследствие на хемодилуцията, вискозитетът на кръвта намалява, венозният приток към сърцето се увеличава и сърдечният дебит се увеличава. Наред с тези ефекти, декстраните образуват комплекси с фибриноген и имат антилипемичен ефект.
По този начин, антиагрегационното действие и хемодинамичните ефекти на нискомолекулните декстрани спомагат за намаляване на вискозитета на кръвта, което е особено важно при ниски скорости на срязване. Дезагрегацията на кръвните клетки подобрява системния кръвен поток и микроциркулацията, особено във венозната му част, където градиентите на скоростта са най-ниски. Използването на нискомолекулни декстранови разтвори при различни видове шок, по време на хирургично лечение на наранявания и техните последици, а след това и в следоперативния период, спомага за предотвратяване на хиперкоагулация и намаляване на вероятността от тромботични процеси и емболия.
Трябва обаче да се отбележи, че в някои случаи инфузиите с декстранови разтвори са съпроводени с анафилактични и алергични реакции (опасни при наличие на сенсибилизация и анафилактичен шок). Това се дължи на факта, че декстраните, които имат голямо молекулно тегло и много странични вериги, могат да действат като антиген. Следователно, за да се установи индивидуалната чувствителност, се препоръчва предварително интравенозно приложение на до 20 ml нискомолекулен декстранов разтвор като хаптен (15% разтвор, молекулно тегло 1000) и провеждане на инфузии на плазмен заместител преди въвеждането на анестезия.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Тромбинови инхибитори
Фармакологичната защита на тромбоцитните рецептори, взаимодействащи с тромбоцитните активатори, може да се постигне и с помощта на агенти, които се конкурират с неполимерните тромбоцитни активатори или ги инхибират. Такива агенти включват тромбинови инхибитори (хепарин и хирудин, редица синтетични инхибитори, адреналинови антагонисти), алфа-рецепторни блокери (фентоламин, дихидроерготамин), ADP антагонисти (дипиридамол, аденозин и неговите структурни аналози, фосфокреатин), серотонинови антагонисти (метисергид). Само няколко от изброените агенти се използват реално за превенция и лечение на шок от различен произход.
Защитата на вътреклетъчните механизми на синтез на протеинови рецептори, които реагират с активатори на тромбоцитната агрегация и адхезия, и инхибирането на процесите на синтез на тромбоксан са възможни с лекарства от различни групи:
- индуктори и стабилизатори на cATP, простациклин и простагландин PgE2;
- инхибитори на фосфолипаза и фосфодиестеразата.
Интензивното разработване на специални антитромбоцитни средства започна сравнително наскоро и все още не е довело до надеждни резултати. В момента в клиничната практика, освен декстранови разтвори, широко се използват антитромбоцитни средства като ацетилсалицилова киселина, индометацин, дипирадамол, сулфинпиразон (персантин), простациклин (ейкопростенон) и хепарин за предотвратяване на образуването на бели тромбоцити.
Нестероидни противовъзпалителни лекарства
Установено е, че фармакологичните ефекти на нестероидните противовъзпалителни средства - ацетилсалицилова киселина и индометацин - се дължат на техния ефект върху метаболизма на ейкозаноидите (тромбоксани и простагландини). Почти всички лекарства от тази група инхибират ензимния комплекс, известен като простагландин синтетаза, като по този начин упражняват своите специфични и антиагрегантни ефекти.
Ацетилсалициловата киселина се абсорбира много бързо след перорално приложение. Продуктът от нейната хидролиза, салициловата киселина, причинява инхибиране на тромбоцитната циклооксигеназа, което нарушава превръщането на арахидоновата киселина в простагландин О2 и в крайна сметка в тромбоксан А2. Ацетилсалициловата киселина инхибира агрегацията, индуцирана от колаген, АДФ, адреналин и серотонин. Въпреки че нейната GG05 е 15 минути, антиагрегантният ефект продължава няколко дни, което очевидно се обяснява с необратимото инхибиране на реакциите на синтез на простагландин и потискане на функцията на агрегация на тромбоцитите през целия им живот (6-10 дни). Наред с инхибирането на тромбоцитната циклооксигеназа, ацетилсалициловата киселина във високи дози инхибира циклооксигеназата на съдовата стена и едновременно с потискането на синтеза на тромбоксан А2 инхибира синтеза на простациклин в ендотелните клетки. Следователно, ацетилсалициловата киселина трябва да се предписва като антиагрегант в малки дози (3000-5000 mg/ден), които предимно инхибират тромбоцитната агрегация.
Като се има предвид, че ацетилсалициловата киселина блокира тромбоцитната циклооксигеназа в продължение на няколко дни, а ендотелната циклооксигеназа - не повече от един ден, е рационално лекарството да се предписва не ежедневно, а на всеки 3-4 дни. Изборът на оптимална доза ацетилсалицилова киселина за пациента трябва да се извършва индивидуално, тъй като има различна чувствителност на пациентите към антитромбоцитния ефект на лекарството. При реактивни пациенти ацетилсалициловата киселина в доза от 0,5 g инхибира тромбоцитната агрегация с 40-50%, при хиперреактивни пациенти - напълно или с 80-90%, а за реактивни пациенти е характерна липсата на антитромбоцитен ефект при прием на същата доза от лекарството.
Селективните инхибитори на тромбоксан синтетазата са имидазол и неговите аналози, които не блокират циклооксигеназата. Дипиридамолът, използван в клиничната практика при лечението на хронична исхемична болест на сърцето като коронарен дилататор, подобно на имидазола, селективно инхибира тромбоксан синтетазата, предотвратявайки синтеза на тромбоксан А2. Смята се, че лекарството и неговите аналози също инхибират тромбоцитната фосфодиестераза, като по този начин повишават концентрацията на цАМФ в тромбоцитите. Наред с това, дипиридамолът инхибира активността на аденозин деаминазата и усвояването на аденозин от тромбоцитите, блокира абсорбцията на серотонин от тромбоцитите и тяхната агрегация, индуцирана от адреналин и колаген. Има съобщения за слаба антитромбоцитна активност на лекарството и способността му в малки дози да усилва тромбоцитната агрегация. Най-надеждният антитромбоцитен ефект може да се постигне с комбинация от дипиридамол и ацетилсалицилова киселина.
Хепарин
Сред антитромботичните средства, един от най-ефективните регулатори на агрегатното състояние на кръвта е хепаринът, особено когато се използва рано. Хепаринът има висок отрицателен заряд и е способен да взаимодейства както с големи, така и с малки йони и молекули (ензими, хормони, биогенни амини, плазмени протеини и др.), така че спектърът на неговото биологично действие е доста широк. Лекарството има антитромбинови, антитромбопластични и антипротромбинови ефекти, предотвратява превръщането на фибриногена във фибрин, потиска ретракцията на съсирека и увеличава фибринолизата.
Механизмът на антикоагулантното действие на хепарина е доста сложен. Вече е установено, че антикоагулантните ефекти на хепарина са свързани с потенциране на действието на антитромбин III и засилване на способността на хепарин-антитромбин III комплекса бързо да инактивира повечето серинови протеази на системата за кръвосъсирване. В антитромботичния ефект на хепарина от голямо значение е способността му да повишава и поддържа висок електроотрицателен потенциал на съдовата интима, предотвратявайки адхезията на тромбоцитите и образуването на тромбоцитни микротромби. Хепаринът най-активно потиска образуването на тромби във вените, предотвратявайки както локалното образуване на тромби, така и дисеминираната интраваскуларна коагулация.
Простациклин и неговите стабилни аналози
Сред антитромбоцитните средства най-мощните инхибитори на агрегацията са простациклинът и неговите стабилни аналози. Антитромбоцитният ефект на простациклина се дължи на стимулиране на аденилат циклазата и, като следствие, на повишаване на концентрацията на цАМФ в тромбоцитите, намаляване на съдържанието на тромбоксан, намаляване на съдържанието на тромбоксан А2 и блокиране на неговите рецептори. Простациклинът е нестабилен и бързо се хидролизира до неактивни продукти, така че се прилага интравенозно капково със скорост от 2 до 20 ng/kg на минута в продължение на 30-60 минути до 6 пъти на ден.
Простациклинът, наред със силен антиагрегационен ефект, има мощен вазодилататорен и бронходилататорен ефект. Лекарството разширява съдовете на мозъка, сърцето, бъбреците, скелетните мускули и мезентериалните съдове. Под влияние на простациклина се увеличава коронарният кръвен поток, енергийното снабдяване на миокарда се увеличава и нуждата му от кислород намалява. Въпреки нестабилността му в организма, клинично благоприятните ефекти могат да продължат няколко седмици и дори месеци. Механизмът на такова продължително действие все още не е изяснен.
Простациклинът е нискотоксично лекарство, но употребата му може да причини странични ефекти: зачервяване на лицето, главоболие, понижено кръвно налягане, коремна болка, анорексия. Наред с простациклина, неговите синтетични стабилни аналози (илопрост и др.) са обещаващи инхибитори на тромбоцитната агрегация.
Лекарства, които подобряват вискозитета на кръвта
Нарушенията в реологичните свойства на кръвта по време на травма и шок се причиняват не само от промени във функционалната активност на тромбоцитите, но и от повишаване на вискозитета на кръвта. Структурният вискозитет на кръвта като сложна динамична дисперсна система се определя до голяма степен от вискозитета на плазмата и способността на еритроцитите да се деформират. Вискозитетът на плазмата зависи главно от концентрацията на протеини в кръвта. Протеините с малко молекулно тегло, като албумин, имат малък ефект върху вискозитета на плазмата, докато протеините с голяма молекула (фибриноген, алфа- и гама-глобулини, други макромолекули) го повишават значително.
При ниски скорости на срязване, адсорбцията на фибриноген и глобулини върху повърхността на еритроцитите води до образуване на мостове между съседни клетки и образуване на агрегати от еритроцитите. Скоростта на образуване на агрегати е сложен биофизичен процес и зависи не само от величината на срязването, но и от електрокинетичните свойства на еритроцитите, концентрацията, масата и сорбционния капацитет на макромолекулите-агрегатори, от формата и пластичността на еритроцитите.
Поддържането на формата и механичните свойства на еритроцитната мембрана изисква значителен разход на енергия. Смята се, че енергията, произведена в еритроцитите по време на гликолизата, се изразходва за фосфорилиране на спектрин, което води до промени във вторичната структура на протеина и взаимодействие със съседните компоненти на вътрешната мембрана. Взаимодействието между структурните протеини на мембраната, спектрин и актин, играе важна роля във формирането на механичните свойства на еритроцитната мембрана, в поддържането на постоянна повърхност на еритроцита и неговата дебелина при всяка деформация.
При системни хемодинамични и органни нарушения на кръвообращението, повишаването на ригидността на еритроцитните мембрани и образуването на еритроцитни агрегати води до намаляване на скоростта на преминаване на еритроцитите през капилярите, като по този начин се нарушава газотранспортната функция на кръвта. Следователно, корекцията на нарушенията на реологичните свойства на кръвта при шок трябва да включва, наред с предотвратяването на агрегацията на еритроцитите, нормализиране на плазмения и кръвния вискозитет, агрегацията и деформацията на еритроцитите.
В допълнение към нискомолекулните декстрани, албуминовите разтвори са едно от ефективните средства за повишаване на суспензионната стабилност на кръвта. В късния период на шок настъпва генерализирана агрегация на еритроцитите на фона на намаляване на концентрацията на албумин в кръвната плазма и повишаване на концентрацията на фибриноген и глобулини, особено алфа2 фракцията, липопротеини и липиди. При тези условия реологичните ефекти на албумина се дължат на два основни фактора: хемодилуция и нормализиране на съотношението между микро- и макроглобуларните протеини в плазмата. В същото време албуминът свързва свободните киселини, чието лабилизиране по време на травма и шок стимулира агрегацията на клетъчните структури на кръвта и вътресъдовата коагулация и може да причини мастна емболия.
Противошоковите мерки, насочени към попълване на обема на циркулиращата кръв, елиминиране на тъканната хипоксия и метаболитната ацидоза, допринасят за нормализиране на еластичността на еритроцитните мембрани, тъй като хипоксията и ацидозата значително намаляват деформируемостта на еритроцитите. Повишената твърдост на еритроцитните мембрани при шок вероятно е свързана с инхибиране на синтеза на АТФ в еритроцитите. От своя страна, намаляването на концентрацията на АТФ допринася за повишаване на концентрацията на Ca2+ в еритроцитите, което, чрез свързване с мембранните протеини, увеличава твърдостта на мембраната.
Едно от фармакологичните лекарства, което повишава съдържанието на АТФ в еритроцитите и еластичността на еритроцитните мембрани, е Трентал (пентоксифилин), който се използва в клиничната практика за лечение на исхемични нарушения.
Наред с намаляването на ригидността на еритроцитните мембрани, Трентал причинява вазодилатация, подобрява тъканната оксигенация, инхибира фосфодиестеразната активност в тъканите, повишава концентрацията на цАМФ и инхибира агрегацията на тромбоцитите.
Сред другите фармакологични средства, които поддържат еластичността на еритроцитната мембрана, заслужава да се отбележат Ca2+ антагонистите, които ограничават потока на йони в еритроцитите (флунаризин, нифедипин и др.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Внимание!
За да се опрости възприемането на информацията, тази инструкция за употреба на наркотика "Лекарства за предотвратяване на тромбоза и подобряване на реологията на кръвта" е преведена и представена в специален формуляр въз основа на официалните инструкции за медицинска употреба на лекарството. Преди употреба прочетете анотацията, която се появи директно към лекарството.
Описание, предоставено за информационни цели и не е ръководство за самолечение. Необходимостта от това лекарство, целта на режима на лечение, методите и дозата на лекарството се определя единствено от лекуващия лекар. Самолечението е опасно за вашето здраве.

