Медицински експерт на статията
Нови публикации
Лечение на тежък сепсис и септичен шок
Последно прегледани: 04.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Ефективното лечение на сепсис е възможно само с пълна хирургична санация на огнището на инфекцията и адекватна антимикробна терапия. Неадекватната начална антимикробна терапия е рисков фактор за смърт при пациенти със сепсис. Поддържането на живота на пациента, предотвратяването и елиминирането на органни дисфункции са възможни само с целенасочена интензивна грижа.
Основната му цел е да оптимизира транспорта на О2 при условия на повишената му консумация, характерна за тежък сепсис и септичен шок. Това лечение се осъществява чрез хемодинамична и дихателна поддръжка.
Хемодинамична подкрепа
Инфузионна терапия
Инфузионната терапия е една от първоначалните мерки за поддържане на хемодинамиката и преди всичко на сърдечния дебит. Основните ѝ задачи при пациенти със сепсис са:
- възстановяване на адекватна тъканна перфузия,
- корекция на нарушенията на хомеостазата,
- нормализиране на клетъчния метаболизъм,
- намаляване на концентрацията на медиатори на септичната каскада и токсични метаболити.
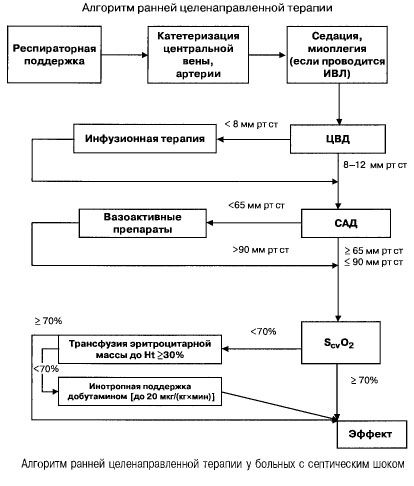
При сепсис с полиорганна недостатъчност и септичен шок се опитват бързо (в рамките на първите 6 часа) да постигнат следните стойности на важни показатели:
- хематокрит >30%,
- диуреза 0,5 мл/(кг/ч),
- сатурация на кръвта в горната празна вена или дясното предсърдие >70%,
- средно кръвно налягане >65 mm Hg,
- ЦВТ 8-12 mm Hg
Поддържането на тези стойности на определеното ниво подобрява преживяемостта на пациентите (категория на доказателствата B). Хемодинамичното наблюдение с помощта на катетър Swan-Ganz и PICCO технология (транспулмонална термодилуция и анализ на пулсовата вълна) разширяват възможностите за наблюдение и оценка на ефективността на хемодинамичната терапия, но няма доказателства, че те подобряват преживяемостта.
Оптималната стойност на предварителното натоварване се избира индивидуално, тъй като е необходимо да се вземат предвид степента на ендотелно увреждане и състоянието на лимфния дренаж в белите дробове, диастоличната функция на камерите и промените в интраторакалното налягане. Обемът на инфузионната терапия се избира така, че PCWP да не надвишава плазмения COP (превенция на OL) и да има увеличение на CO. Освен това се вземат предвид параметрите, характеризиращи газообменната функция на белите дробове (paO2 и paO2 / FiO2 ) и промените в рентгенографската картина.
За инфузионна терапия като част от целенасоченото лечение на сепсис и септичен шок се използват кристалоидни и колоидни разтвори с практически идентични резултати.
Всички инфузионни среди имат както предимства, така и недостатъци. Днес, предвид резултатите от експериментални и клинични проучвания, няма причина да се предпочита някой конкретен вид.
- Например, за адекватна корекция на венозния обратен поток и нивото на предварително натоварване е необходимо да се приложи обем кристалоиди 2-4 пъти по-голям от този на колоидите, което е свързано с особеностите на разпределението на разтвора в организма. Освен това, инфузията на кристалоиди е свързана с по-голям риск от тъканен оток, а хемодинамичният им ефект е по-кратък от този на колоидите. В същото време кристалоидите са по-евтини, не влияят на коагулационния потенциал и не провокират анафилактоидни реакции. Въз основа на гореизложеното, качественият състав на инфузионната програма се определя в зависимост от характеристиките на пациента, като се вземат предвид степента на хиповолемия, фазата на DIC синдрома, наличието на периферен оток и концентрацията на албумин в кръвния серум, тежестта на острото белодробно увреждане.
- Плазмени заместители (декстрани, желатинови препарати, хидроксиетил нишесте) са показани в случаи на тежък дефицит на базалноклеточен кръвоток. Хидроксиетил нишестетата със степен на заместване 200/0,5, 130/0,4 и 130/0,42 имат потенциално предимство пред декстраните поради по-ниския риск от излизане от мембраната и липсата на клинично значим ефект върху хемостазата.
- Въвеждането на албумин при критични състояния може да увеличи риска от смърт. Увеличаването на COP по време на инфузията му е преходно и след това, при условия на повишена пропускливост на капилярното легло (синдром на "капилярно изтичане"), настъпва по-нататъшно екстравазиране на албумин. Възможно е трансфузията на албумин да бъде полезна само ако концентрацията му в серума е по-малка от 20 g/l и няма признаци на "изтичане" в интерстициума.
- Употребата на криоплазма е показана при консумативна коагулопатия и намален коагулационен потенциал на кръвта.
- Широкото използване на донорска еритроцитна маса трябва да бъде ограничено поради високия риск от развитие на различни усложнения (остра пулмонална лейкемия, анафилактични реакции и др.). Според повечето експерти минималната концентрация на хемоглобин при пациенти с тежък сепсис е 90-100 g/l.
Корекция на хипотонията
Ниското перфузионно налягане изисква незабавно активиране на лекарства, които повишават съдовия тонус и/или инотропната функция на сърцето. Допаминът или норепинефринът са лекарствата от първа линия за коригиране на хипотонията при пациенти със септичен шок.
Допаминът (допмин) в доза <10 мкг/(кг x мин) повишава кръвното налягане, предимно чрез увеличаване на CO, и има минимален ефект върху системното съдово съпротивление. При високи дози, неговият α-адренергичен ефект преобладава, което води до артериална вазоконстрикция, а при доза <5 мкг/(кг x мин) допаминът стимулира допаминергичните рецептори на бъбречните, мезентериалните и коронарните съдове, което води до вазодилатация, повишена гломерулна филтрация и екскреция на Na+.
Норепинефринът повишава средното артериално налягане и увеличава гломерулната филтрация. Оптимизирането на системната хемодинамика под негово действие води до подобряване на бъбречната функция без използване на ниски дози допамин. Проучвания през последните години показват, че изолираното му приложение, в сравнение с комбинацията с високи дози допамин, води до статистически значимо намаляване на смъртността.
Адреналинът е адренергично лекарство с най-силно изразени хемодинамични странични ефекти. Той има дозозависим ефект върху сърдечната честота, средното артериално налягане, сърдечния дебит, функцията на лявата камера и доставянето и консумацията на O2 . Въпреки това, тахиаритмии, влошаване на органния кръвоток и хиперлактатемия се появяват едновременно. Следователно, употребата на адреналин е ограничена до случаи на пълна рефрактерност към други катехоламини.
Добутаминът е лекарството по избор за увеличаване на доставянето и консумацията на CO2 и O2 при нормално или повишено предварително натоварване. Поради преобладаващото си действие върху бета1-адренергичните рецептори, той е по-ефективен от допамина за повишаване на тези параметри.
Експериментални изследвания показват, че катехоламините, освен че подпомагат кръвообращението, могат да регулират протичането на системното възпаление, като влияят върху синтеза на ключови медиатори с отдалечен ефект. Под влияние на адреналин, допамин, норадреналин и добутамин, активираните макрофаги намаляват синтеза и секрецията на TNF-α.
Изборът на адренергични средства се извършва съгласно следния алгоритъм:
- сърдечен индекс 3,5-4 л/(мин x м² ), SvO² > 70% - допамин или норепинефрин,
- сърдечен индекс <3,5 l/(min x m² ), SvO² <70% - добутамин (ако систоличното кръвно налягане <70 mm Hg - заедно с норепинефрин или допамин).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Дихателна подкрепа
Белите дробове са сред първите органи-мишени, въвлечени в патологичния процес при сепсис. Острата дихателна недостатъчност е един от водещите компоненти на полиорганната дисфункция. Нейните клинични и лабораторни прояви при сепсис съответстват на ALI, а с прогресията на патологичния процес - ARDS. Показанията за механична вентилация при тежък сепсис се определят в зависимост от тежестта на паренхиматозната дихателна недостатъчност (ARF или ARDS). Нейният критерий е дихателният индекс:
- <200 - показана е трахеална интубация и дихателна поддръжка,
- >200 - показанията се определят индивидуално.
Ако пациентът е в съзнание по време на спонтанно дишане с кислородна поддръжка, няма висок разход на дихателна работа и изразена тахикардия (HR <120 в минута), нормалната стойност на венозния обратен поток SO2 > 90%, тогава е възможно да се въздържи от прехвърлянето му на изкуствена вентилация. Необходимо е обаче внимателно да се следи състоянието на пациента. Оптималната стойност на SO2 е около 90%. Тя може да се поддържа чрез различни методи за подаване на газ (лицеви маски, назални катетри) в нетоксични концентрации (FiO2 < 0,6). Неинвазивната изкуствена вентилация е противопоказана при сепсис (категория на доказателства B).
Режимите на високообемна механична вентилация (ВО2 = 12 ml/kg) трябва да се избягват, тъй като в такива случаи секрецията на цитокини от белите дробове се увеличава, което води до влошаване на МОН. Необходимо е да се придържаме към концепцията за безопасна механична вентилация, която е възможна, ако са изпълнени следните условия (категория на доказателства А):
- разтворен кислород <10 мл/кг,
- неинвертирано съотношение на вдишване и издишване,
- пиково налягане в дихателните пътища <35 cm H2O,
- FiO2 < 0,6.
Изборът на параметри на дихателния цикъл се извършва до постигане на адекватна механична вентилация, като критериите са paO2 > 60 mm Hg, SpO2 > 88-93%, pvO2 35-45 mm Hg, SvO2 > 55%.
Един от ефективните методи за оптимизиране на газообмена е извършването на изкуствена вентилация в положение по корем (Prone Positioning) (категория на доказателства B). Тази позиция е ефективна при пациенти в най-тежко състояние, въпреки че ефектът ѝ върху намаляването на смъртността в дългосрочен период е статистически незначителен.
Хранителна подкрепа
Провеждането на изкуствена хранителна поддръжка е важен елемент от лечението, една от задължителните мерки, тъй като развитието на синдрома на полиорганна недостатъчност при сепсис обикновено е съпроводено с прояви на хиперметаболизъм. В такава ситуация енергийните нужди се задоволяват чрез разрушаване на собствените клетъчни структури (автоканибализъм), което влошава органната дисфункция и увеличава ендотоксикозата.
Хранителната подкрепа се разглежда като метод за предотвратяване на тежко изтощение (протеиново-енергиен дефицит) на фона на изразено повишаване на ката- и метаболизма. Включването на ентерално хранене в комплекса на интензивната терапия предотвратява движението на чревната микрофлора, дисбактериозата, повишава функционалната активност на ентероцитите и защитните свойства на чревната лигавица. Тези фактори намаляват степента на ендотоксикоза и риска от вторични инфекциозни усложнения.
Изчисляване на хранителната подкрепа:
- енергийна стойност - 25-35 kcal/(кг телесно тегло x ден),
- количество протеин - 1,3-2,0 г/(кг телесно тегло x ден),
- количество въглехидрати (глюкоза) - по-малко от 6 г/кг/ден,
- количество мазнини - 0,5-1 г/кг/ден,
- глутаминови дипептиди 0,3-0,4 g/kg/ден,
- витамини - стандартен дневен набор + витамин К (10 мг/ден) + витамини B1 и B6 ( 100 мг/ден) + витамини A, C, E,
- микроелементи - стандартен дневен прием + Zn (15-20 мг/ден + 10 мг/ден при наличие на разхлабени изпражнения),
- електролити - Na+, K+, Ca2+ според балансови изчисления и концентрация в плазмата.
Ранното започване на хранителна поддръжка (24-36 часа) е по-ефективно, отколкото на 3-4-ия ден от интензивната терапия (категория на доказателства B), особено при ентерално хранене със сонда.
При тежък сепсис няма предимства на ентералното или парентералното хранене; продължителността на органната дисфункция и продължителността на дихателната и инотропната подкрепа са еднакви, а смъртността е еднаква. Предвид гореизложеното, ранното ентерално хранене е по-евтина алтернатива на парентералното хранене. Използването на смеси, обогатени с диетични фибри (пребиотици), за хранене през сонда значително намалява честотата на диария при пациенти с тежък сепсис.
За ефективен синтез на протеини в организма е важно да се поддържа метаболитно съотношение „общ азот, g - непротеинови калории, kcal“ = 1-(110-130). Максималната доза въглехидрати е 6 g / (kg телесно тегло на ден), тъй като въвеждането на големи дози заплашва с хипергликемия и активиране на катаболизма в скелетните мускули. Препоръчва се мастните емулсии да се прилагат денонощно.
Противопоказания за хранителна поддръжка:
- декомпенсирана метаболитна ацидоза,
- индивидуална непоносимост към хранителни вещества,
- тежка невъзстановена хиповолемия,
- рефракторен шок - доза допамин >15 mcg/(kg x min) и систолично кръвно налягане <90 mm Hg,
- тежка нелечима артериална хипоксемия.
Гликемичен контрол
Важен аспект на комплексното лечение на тежък сепсис е постоянното наблюдение на концентрацията на глюкоза в кръвната плазма и инсулиновата терапия. Високата гликемия и необходимостта от нейната корекция са фактори за неблагоприятен изход при сепсис. Предвид горепосочените обстоятелства, при пациентите се поддържа нормогликемия (4,5-6,1 mmol/l), за което, когато концентрацията на глюкоза се повиши над допустимите стойности, се извършва инсулинова инфузия (0,5-1 U/h). В зависимост от клиничната ситуация, концентрацията на глюкоза се следи на всеки 1-4 часа. При прилагането на този алгоритъм е отбелязано статистически значимо увеличение на преживяемостта на пациентите.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Глюкокортикоиди
Резултатите от съвременните проучвания относно ефективността на употребата на глюкокортикоиди при пациенти със септичен шок са обобщени в следните твърдения:
- Неподходящо е да се използват хормони във високи дози [метилпреднизолон 30-120 mg/(kg x ден) веднъж или в продължение на 9 дни, дексаметазон 2 mg/(kg x ден) в продължение на 2 дни, бетаметазон 1 mg/(kg x ден) в продължение на 3 дни] - повишен риск от вътреболнични инфекции, без ефект върху преживяемостта,
- Употребата на хидрокортизон в доза 240-300 mg дневно в продължение на 5-7 дни ускорява стабилизирането на хемодинамичните параметри, позволява спиране на съдовата поддръжка и подобрява преживяемостта при пациенти със съпътстваща относителна надбъбречна недостатъчност (категория на доказателства B).
Необходимо е да се изостави хаотичното емпирично предписване на преднизолон и дексаметазон - няма основания за екстраполиране на нова информация към тях. При липса на лабораторни данни за относителна надбъбречна недостатъчност се прилага хидрокортизон в доза от 300 mg на ден (в 3-6 инжекции).
- при рефракторен шок,
- ако са необходими високи дози вазопресори за поддържане на ефективна хемодинамика.
Възможно е в условия на системно възпаление при септичен шок, ефективността на хидрокортизона да е свързана с активирането на инхибитора на ядрения фактор kB (NF-kB-a) и корекцията на относителната надбъбречна недостатъчност. От своя страна, инхибирането на активността на транскрипционния ядрен фактор (NF-kB) води до намаляване на образуването на индуцируема NO синтетаза (NO е най-мощният ендогенен вазодилататор), провъзпалителни цитокини, COX и адхезионни молекули.
Активиран протеин С
Една от характерните прояви на сепсиса е нарушаване на системната коагулация (активиране на коагулационната каскада и инхибиране на фибринолизата), което в крайна сметка води до хипоперфузия и органна дисфункция. Ефектът на активирания протеин С върху възпалителната система се реализира по няколко начина:
- намаляване на прикрепването на селектина към левкоцитите, което предпазва ендотела от увреждане, играейки ключова роля в развитието на системно възпаление,
- намалено освобождаване на цитокини от моноцитите,
- блокиране на освобождаването на TNF-α от левкоцитите,
- инхибиране на производството на тромбин (това потенцира възпалителния отговор).
Антикоагулантно, профибринолитично и противовъзпалително действие
- активираният протеин С се дължи на
- разграждане на фактори Va и VIIIa - потискане на образуването на тромби,
- потискане на инхибитора на плазминогенния активатор - активиране на фибринолизата,
- директен противовъзпалителен ефект върху ендотелните клетки и неутрофилите,
- защита на ендотела от апоптоза
Приложението на активиран протеин C [дротрекогин алфа (активиран)] в доза 24 mcg/(kg h) за 96 h намалява риска от смърт с 19,4%. Показания за приложение: сепсис с остра MOF и висок риск от смърт (APACHE II > 25 точки, дисфункция на 2 или повече органа, категория на доказателства B).
Активираният протеин С не намалява смъртността при деца, пациенти с едноорганна дисфункция, APACHE II < 25 точки, при пациенти с нехирургичен сепсис.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Имуноглобулини
Препоръчителността на интравенозното приложение на имуноглобулини (IgG и IgG+IgM) се свързва с тяхната способност да ограничават прекомерното действие на провъзпалителните цитокини, да увеличават клирънса на ендотоксини и стафилококов суперантиген, да елиминират анергията и да усилват ефекта на β-лактамните антибиотици. Използването им при лечение на тежък сепсис и септичен шок е единственият метод за имунокорекция, който увеличава преживяемостта. Най-добър ефект е регистриран при използване на комбинация от IgG и IgM [RR=0,48 (0,35-0,75), категория на доказателства А]. Стандартният дозов режим е 3-5 ml/(kg x ден) в продължение на 3 последователни дни. При използване на имуноглобулини, най-оптимални резултати са получени в ранната фаза на шока („топъл шок“) и при пациенти с тежък сепсис (APACHE II оценка от 20-25 точки).
Превенция на дълбока венозна тромбоза
Превенцията на дълбока венозна тромбоза (ДВТ) на долните крайници значително влияе върху резултатите от лечението при пациенти със сепсис (категория на доказателства А). За тази цел се използват както нефракционирани, така и нискомолекулни хепарини. Основните предимства на нискомолекулните хепарини са по-ниската честота на хеморагични усложнения, по-слабият ефект върху тромбоцитната функция и дълготрайният ефект (може да се прилага веднъж дневно).
Предотвратяване на образуването на стресови язви на стомашно-чревния тракт
Тази насока играе съществена роля за благоприятен изход при лечението на пациенти с тежък сепсис и септичен шок, тъй като смъртността от кървене от стрес язви на стомашно-чревния тракт е 64-87%. Без превантивни мерки стрес язви се срещат при 52,8% от критично болните пациенти. Въпреки това, употребата на инхибитори на протонната помпа и блокери на хистаминовите H2 рецептори намалява риска повече от 2 пъти (първата група лекарства е по-ефективна от втората). Основната насока на превенция и лечение е поддържане на pH в рамките на 3,5-6,0. Трябва да се подчертае, че освен гореспоменатите лекарства, ентералното хранене играе важна роля за предотвратяване образуването на стрес язви.
Екстракорпорално пречистване на кръв
Различни биологично активни вещества и метаболитни продукти, участващи в развитието на генерализирано възпаление, са мишени за детоксикационни методи, което е особено важно при липса на естествен хепаторенален клирънс в условия на полиорганна недостатъчност. Методите за бъбречна заместителна терапия се считат за обещаващи, тъй като могат да повлияят не само на уремичните нарушения при пациенти с бъбречна недостатъчност, но и да имат положителен ефект върху други промени в хомеостазата и органни дисфункции, които се наблюдават при сепсис, шок и полиорганна недостатъчност.
Към днешна дата няма данни, потвърждаващи необходимостта от използване на екстракорпорални методи за пречистване на кръвта като едно от основните направления на патогенетичната терапия на сепсис и септичен шок. Тяхното приложение е оправдано при полиорганна недостатъчност с бъбречно доминиране.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Хемодиализа
Същността на метода е дифузия на вещества с ниско молекулно тегло (до 5x103 Da ) през полупропусклива мембрана и отстраняване на излишната течност от тялото по градиент на налягането. Хемодиализата се използва широко за лечение на пациенти както с хронична, така и с остра бъбречна недостатъчност. Скоростта на дифузия на веществата зависи експоненциално от тяхното молекулно тегло. Например, отстраняването на олигопептидите е по-бавно от техния синтез.
Хемофилтрация
Хемофилтрацията е ефективен метод за отстраняване на вещества с молекулно тегло 5x10³ - 5x10⁴ Da и единственият начин за отстраняване на голяма група биологично активни вещества и метаболити от организма. Методът се основава на конвекционния метод на масопренос. В допълнение към адекватната корекция на азотемията, хемофилтрацията ефективно премахва анафилатоксините C3a, C5a, провъзпалителните цитокини (TNF-a, IL-1b, 6 и 8), ß2-микроглобулин, миоглобин, паратироиден хормон, лизозим (молекулно тегло - 6000 Da), α-амилаза (молекулно тегло - 36 000-51 000 Da), креатин фосфокиназа, алкална фосфатаза, трансаминази и други вещества. Хемофилтрацията премахва аминокиселини и плазмени протеини (включително имуноглобулини и циркулиращи имунни комплекси).
Хемодиафилтрация
Хемодиафилтрацията е най-мощният метод за пречистване на кръвта, комбиниращ дифузия и конвекция (т.е. GD и GF). Допълнителен принос към процеса на детоксикация дава сорбцията на патологични вещества върху филтърната мембрана.
Плазмафереза
Плазмаферезата (плазмафереза, плазмена филтрация) също се разглежда като възможен метод за коригиране на генерализирано възпаление при пациенти със сепсис и септичен шок. Оптималният метод се счита за използване на плазмафереза в непрекъснат режим с отстраняване на 3-5 обема плазма и едновременното ѝ заместване с прясно замразени, албуминови, колоидни и кристалоидни разтвори. С коефициент на пресяване 1, плазмената филтрация осигурява добро отстраняване на С-реактивен протеин, хаптоглобин, комплементен фрагмент С3, 1-антитрипсин, IL-6, тромбоксан-B2, гранулоцит-стимулиращ фактор, TNF. Използването на сорбенти за пречистване на плазмата на пациента намалява риска от инфекция и намалява цената на процедурата, тъй като не е необходимо да се използват чужди протеини.
Употребата на продължителна инфузия на натриев селенит (селеназа) 1000 mcg/ден при тежък сепсис води до намаляване на смъртността.
Селенът е есенциален микроелемент, чието значение се свързва с ключовата му роля в антиоксидантните системи на клетките. Нивото на селен в кръвта се поддържа в рамките на 1,9-3,17 μM/l. Нуждата от селен е 50-200 μg на ден и зависи от наличието на други антиоксиданти и микроелементи.
Селенът е мощен антиоксидант, компонент на глутатион пероксидазата, фосфолин глутатион пероксидазата, други оксидоредуктази и някои трансферази. Глутатион пероксидазата е най-важното звено в ендогенната антиоксидантна система.
Ефективността на селена при критични състояния е изследвана през последните години. Тези изследвания показват, че основните механизми на действие на селена са:
- потискане на хиперактивацията на NF-kB;
- намалена активация на комплемента;
- действието му като имуномодулатор, антиоксидант и противовъзпалително средство
- поддържане на усвояването на пероксид;
- потискане на ендотелната адхезия (намалена експресия на ICAM-1, VCAM-2,
- Е - селектин, Р - селектин);
- защита на ендотела от оксирадикали (с помощта на селенопротеин Р, който предотвратява образуването на пероксинитрит от O2 и NO).
В обобщение на гореизложеното, можем да дефинираме специфични задачи на интензивното лечение при тежък сепсис:
- Хемодинамична поддръжка: CVP 8-12 mm Hg, средно кръвно налягане >65 mm Hg, диуреза 0,5 ml/(kg h), хематокрит >30%, сатурация на смесена венозна кръв >70%.
- Пиково налягане в дихателните пътища при дихателна поддръжка <35 cm H2O, инспираторна фракция на кислород <60%, дихателен обем <10 ml/kg, неинвертирано инспираторно/експираторно съотношение.
- Глюкокортикоиди - „ниски дози“ (хидрокортизон 240-300 мг на ден).
- Активиран протеин C 24 mcg/(kg h) за 4 дни при тежък сепсис (APACHE II >25).
- Имунокорекционна заместителна терапия с пентаглобин.
- Профилактика на дълбока венозна тромбоза на долните крайници.
- Предотвратяване на образуването на стрес язви на стомашно-чревния тракт: употреба на инхибитори на протонната помпа и блокери на H2-хистаминовите рецептори.
- Заместителна терапия за остра бъбречна недостатъчност.
- Хранителна подкрепа: енергийна стойност на храната 25-30 kcal/kg телесно тегло x ден), протеини 1,3-2,0 g/(kg телесно тегло x ден), глутаминови дипептиди 0,3-0,4 g/(kg x ден), глюкоза - 30-70% от непротеиновите калории, при условие че гликемията се поддържа <6,1 mmol/l, мазнини - 15-50% от непротеиновите калории.

