Медицински експерт на статията
Нови публикации
Обичаен спонтанен аборт - Причини
Последно прегледани: 04.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
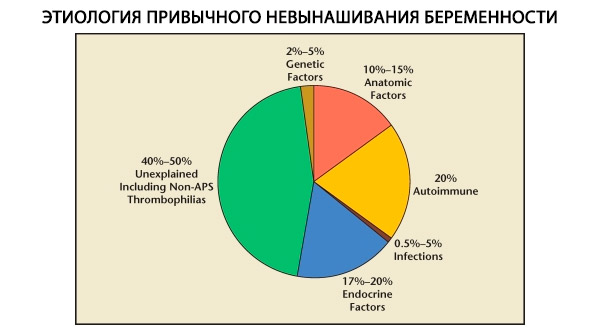
В структурата на обичайните спонтанни аборти се разграничават генетични, анатомични, ендокринни, имунологични и инфекциозни фактори. Когато всички горепосочени причини се изключат, остава група пациентки, при които произходът на обичайния спонтанен аборт е неясен (идиопатични спонтанни аборти). Според C. Coulam et al. (1996) 80% от идиопатичните спонтанни аборти се основават на неразпознати имунни нарушения.
Няма убедителни доказателства, че ендометриозата причинява повтарящи се спонтанни аборти или че медицинското или хирургичното лечение на ендометриозата намалява честотата на повтарящи се спонтанни аборти.
Според съвременните схващания, освен генетични и частично инфекциозни причини, водещи до образуването на анормален ембрион, осъществяването на увреждащия ефект на други фактори (анатомични, ендокринни, имунологични) се състои в създаване на неблагоприятен фон за развитието на генетично пълноценна оплодена яйцеклетка, което води до изчерпване на резервния капацитет на хориона и спиране на развитието (ембриогенезата). Критичните периоди през първия триместър на бременността се разпознават като 6-8 седмици (смърт на ембриона) и 10-12 седмици (изхвърляне на оплодената яйцеклетка).
 [ 1 ]
[ 1 ]
Генетични причини за обичаен спонтанен аборт
Генетичните фактори са причина за 3–6% от причините за обичайни спонтанни аборти. При спорадично прекъсване на бременността през първия триместър около 50% от абортите са с хромозомни аномалии. Повечето от тях (95%) са промени в броя на хромозомите - монозомия (загуба на една хромозома), тризомия (наличие на допълнителна хромозома), които са резултат от грешки в мейозата, както и полиплоидия (увеличение на хромозомния състав с пълен хаплоиден набор), която възниква, когато яйцеклетката се оплоди от два или повече сперматозоида. При спорадични спонтанни аборти най-често се среща тризомия - 60% от всички мутации (най-често на хромозома 16, както и 13, 18, 21, 22), на второ място по честота е синдромът на Шерешевски-Търнър (хромозома 45 X0) - 20%, останалите 15% се дължат на полиплоидия (особено триплоидия).
В случай на промяна в броя на хромозомите при аборт, изследването на кариотипа на родителите най-често не разкрива никаква патология и вероятността за хромозомно заболяване на плода по време на последваща бременност е 1%. За разлика от това, при изследване на аборти при двойки с обичаен спонтанен аборт, структурни промени в хромозомите (интра- и интерхромозомни) се наблюдават в 3-6% от случаите. При изследване на кариотипа на родителите, балансирани хромозомни пренареждания се откриват в 7% от случаите. Най-често това са реципрочни транслокации, при които сегмент от една хромозома се намира на мястото на друг сегмент от нехомоложна хромозома, както и мозаицизъм на половите хромозоми, инверсия и откриване на хромозоми под формата на пръстен. В случай на наличие на такива пренареждания при един от съпрузите, процесите на сдвояване и разделяне на хромозомите са затруднени по време на мейозата, което води до загуба (делеция) или удвояване (дупликация) на хромозомни участъци в гаметите. Това води до така наречените небалансирани хромозомни пренареждания, при които ембрионът е или нежизнеспособен, или служи като носител на тежка хромозомна патология. Вероятността да се роди дете с небалансирани хромозомни аномалии при наличие на балансирани хромозомни пренареждания в кариотипа на един от родителите е 1–15%. Разликите в данните са свързани с естеството на пренарежданията, размера на засегнатите сегменти, пола на носителя и фамилната анамнеза.
Диагностика
Анамнеза
- Наследствени заболявания при членове на семейството.
- Наличие на вродени аномалии в семейството.
- Раждане на деца с умствена изостаналост.
- Наличие на безплодие и/или спонтанен аборт с неизвестен произход при семейна двойка или при роднини.
- Наличие на неясни случаи на перинатална смъртност.
Специални методи на изследване
- Изследване на кариотипа на родителите е особено показано за семейни двойки при раждане на новородено с дефекти в развитието, в допълнение към анамнеза за спонтанен аборт, както и в случаи на обичаен спонтанен аборт в ранните етапи на бременността.
- Цитогенетичен анализ на аборт в случаи на мъртво раждане или неонатална смъртност.
Показания за консултация с други специалисти
Ако при родителите се открият промени в кариотипа, е необходима консултация с генетик, за да се оцени степента на риск от раждане на дете с патология или, ако е необходимо, да се вземе решение за даряване на яйцеклетка или сперматозоиди.
По-нататъшно лечение на пациента
Ако семейна двойка има патологичен кариотип, дори при единия от родителите, се препоръчва провеждане на пренатална диагностика по време на бременност - хорионна биопсия или амниоцентеза - поради високия риск от нарушения в развитието на плода.
Анатомични причини за обичаен спонтанен аборт
Анатомичните причини за обичайния спонтанен аборт включват:
- вродени аномалии в развитието на матката (пълно удвояване на матката; двурога, седловидна, еднорогова матка; частична или пълна вътрематочна преграда);
- придобити анатомични дефекти;
- вътрематочни сраствания (синдром на Ашерман);
- субмукозни маточни фиброми;
- истмично-цервикална недостатъчност.
Честотата на анатомичните аномалии при пациенти с обичаен спонтанен аборт варира от 10 до 16%. Честотата на поява на маточни малформации, които могат да доведат до спонтанен аборт (но не и безплодие) спрямо всички маточни малформации е следната: двурога матка - 37%, седловидна матка - 15%, вътрематочна преграда - 22%, пълно удвояване на матката - 11%, еднорога матка - 4,4%.
Диагностика на обичаен спонтанен аборт
Анамнеза
При анатомична патология на матката по-често се наблюдават късни прекъсвания на бременността и преждевременни раждания, но при имплантация върху вътрематочната преграда или близо до миоматозния възел са възможни и ранни прекъсвания на бременността.
За истмично-цервикална недостатъчност патогномоничният признак е спонтанно прекъсване на бременността през втория триместър или ранно преждевременно раждане, което настъпва сравнително бързо и с малка болка.
В случай на малформации на матката е необходимо да се обърне внимание на анамнестични индикации за патология на пикочните пътища (често съпътстваща вродени аномалии на матката) и естеството на развитието на менструалната функция (индикации за хематометра с функциониращ рудиментарен рог на матката).
Специални методи за изследване
- В момента хистеросалпингографията се извършва за установяване на диагноза, която позволява изучаване на формата на маточната кухина, идентифициране на наличието на субмукозни фиброми, сраствания, септи и определяне на проходимостта на фалопиевите тръби. За диагностициране на патологията на матката е рационално хистеросалпингографията да се извърши в периода между менструацията и овулацията, т.е. в първата фаза на менструалния цикъл след спиране на кървавото течение (7-9-ия ден от цикъла). За диагностициране на истмично-цервикална недостатъчност изследването се провежда във втората фаза на менструалния цикъл (18-20-ия ден), за да се определи състоянието на вътрешния отвор на шийката на матката. Преди извършване на хистеросалпингография е необходимо да се изключат възпалителни заболявания на тазовите органи или да се лекуват.
- Хистероскопията е широко разпространена през последните години и се е превърнала в златен стандарт за диагностициране на вътрематочна патология. Поради по-високата си цена в сравнение с хистеросалпингографията обаче, методът се използва при жени с индикация за вътрематочна патология въз основа на предварителни ултразвукови данни. Хистероскопията може да се използва за изследване на маточната кухина, определяне на естеството на вътрематочната патология и, при наличие на необходимото оборудване (резектоскоп), за извършване на минимално инвазивно хирургично лечение - отстраняване на сраствания, субмукозни миомни възли и ендометриални полипи. При отстраняване на вътрематочна преграда се предпочита хистерорезектоскопия с лапароскопски контрол, която предотвратява възможността за перфорация на маточната стена.
- Ултразвукът се извършва в първата фаза на менструалния цикъл, което позволява предполагаема диагноза на субмукозен маточен миом, вътрематочни сраствания, а във втората фаза на цикъла - за идентифициране на вътрематочна преграда и двурога матка. Този метод е от особено значение в ранните етапи на бременността, когато чувствителността му при диагностициране на тези състояния е 100%, а специфичността му е 80%. Извън бременността диагнозата изисква допълнително потвърждение с други методи.
- Чуждестранни автори посочват предимството на сонохистерографията (ултразвук с трансвагинален сензор с предварително въвеждане на 0,9% разтвор на натриев хлорид в маточната кухина) пред хистеросалпингографията, тъй като тя позволява диференциална диагностика между вътрематочната преграда и двурогата матка. Със сонохистерографията е възможно не само да се изследва формата на маточната кухина, но и да се определи конфигурацията на фундуса на тялото на матката. В нашата страна този метод не е получил широко разпространение.
- В някои сложни случаи се използва ЯМР на тазовите органи за потвърждаване на диагнозата. Методът позволява получаване на ценна информация при аномалии в развитието на матката, съпроводени с атипично разположение на органите в таза. ЯМР е важен при рудиментарен рог на матката, за да се реши дали е целесъобразно да се отстрани. Необходимостта от отстраняване на рудиментарния рог на матката възниква в случай на връзката му с тръбата и яйчника, за да се предотврати образуването и развитието на оплодената яйцеклетка в нея. Прекъсването на бременността при анатомични аномалии на матката може да бъде свързано с неуспешна имплантация на оплодената яйцеклетка (върху вътрематочната преграда, близо до субмукозния миомен възел), недостатъчно развита васкуларизация и рецепция на ендометриума, тесни пространствени взаимоотношения в маточната кухина (например при деформация на кухината от миомен възел), често съпроводена с ICI, и хормонални нарушения.
Лечение на обичаен спонтанен аборт
Хирургично лечение
При наличие на вътрематочна преграда, субмукозни миомни възли и сраствания, най-ефективното хирургично лечение е чрез хистерорезектоскопия. Честотата на последващите спонтанни аборти при тази група жени след лечение е 10% в сравнение с 90% преди операцията. При сравняване на резултатите от метропластика, извършена чрез лапаротомия и трансцервикална хистерорезектоскопия, P. Heinonen (1997) получава резултати, показващи по-малка травма и по-голяма ефективност на хистерорезектоскопията; процентът на бременности, довели до раждане на жизнеспособни деца, е съответно 68 и 86%.
Хирургичното отстраняване на вътрематочната преграда, срастванията и субмукозните миомни възли елиминира спонтанен аборт в 70–80% от случаите. То обаче е неефективно при жени с маточни малформации, които са имали нормални раждания с последващи повтарящи се спонтанни аборти. Вероятно в такива случаи анатомичният фактор не е водещата причина и е необходимо да се търсят други причини за спонтанен аборт.
Доказано е, че абдоминалната метропластика е свързана със значителен риск от следоперативно безплодие и не подобрява прогнозата за последваща бременност. Поради това е по-добре да се даде предимство на хистероскопията и лапароскопските операции.
Лечение с наркотици
Ефективността на въвеждането на спиралата, високи дози естрогенни лекарства, въвеждането на катетър на Фоли в маточната кухина след операции за отстраняване на сраствания, вътрематочна преграда не е доказана. Препоръчително е бременността да се планира не по-рано от 3 месеца след операцията. За подобряване на растежа на ендометриума се провежда циклична хормонална терапия в продължение на 3 менструални цикъла [14]. В продължение на 3 месеца през първите 14 дни от цикъла е препоръчително да се приема лекарство, съдържащо 2 mg 17-бета-естрадиол, през следващите 14 дни - 2 mg 17-бета-естрадиол и 20 mg дидрогестерон (10 mg дидрогестерон като част от комбинирано лекарство плюс 10 mg дидрогестерон в отделна таблетна форма).
По-нататъшно лечение на пациента
Характеристики на протичането на бременността с двурога матка или удвояване на матката (когато има 2 маточни кухини):
- в ранните етапи на бременността често се появява кървене от "празния" рог или маточната кухина поради изразена децидуална реакция; тактиката в този случай трябва да бъде консервативна и да се състои в използването на спазмолитични и хемостатични средства;
- заплаха от прекъсване на бременността на различни етапи;
- развитие на истмично-цервикална недостатъчност;
- вътрематочно забавяне на растежа поради плацентарна недостатъчност.
В ранните етапи на бременността, при кървене, се препоръчва почивка на легло и полу-почивка на легло, както и прием на хемостатични, спазмолитични и седативни лекарства, и терапия с гестагени (дидрогестерон в дневна доза от 20 до 40 mg) до 16–18 гестационна седмица.
Ендокринни причини за обичаен спонтанен аборт
Според различни автори, ендокринните причини за спонтанен аборт представляват от 8 до 20%. Най-значимите от тях са дефицит на лутеалната фаза (LPD), хиперсекреция на LH, дисфункция на щитовидната жлеза и захарен диабет.
Тежкото заболяване на щитовидната жлеза или захарният диабет могат да доведат до повтарящи се спонтанни аборти. При компенсиран захарен диабет обаче рискът от хабитуални спонтанни аборти не се различава от този в общата популация.
В същото време, високата честота на хипотиреоидизъм в популацията изисква скрининг с измерване на нивата на TSH. При пациенти с обичаен спонтанен аборт, лутеална фазова недостатъчност се наблюдава в 20–60% от случаите, а ултразвукови признаци на поликистозни яйчници - в 44–56%. Според литературата, влиянието на отделните хормонални нарушения върху формирането на симптомокомплекса на обичайния спонтанен аборт остава спорно. Проучванията на M. Ogasawara et al. (1997) не разкриват достоверни разлики в честотата на прекъсване на бременността със и без LPI при пациенти с два или повече предишни спонтанни аборта в анамнезата, с изключение на автоимунни, анатомични и инфекциозни причини.
Недостатъчността на функцията на жълтото тяло може да бъде резултат от редица неблагоприятни фактори:
- нарушения в секрецията на FSH и LH в първата фаза на менструалния цикъл;
- ранен или, обратно, твърде късен пик на освобождаване на LH;
- хипоестрогенизъм като следствие от неадекватна фоликулогенеза. Всички тези състояния не подлежат на корекция чрез заместителна терапия с гестагенни лекарства в постовулаторния период. Проспективни проучвания, проведени от L. Regan et al., показват значително увеличение на честотата на спонтанните аборти при пациенти с хиперсекреция на LH на 8-ия ден от менструалния цикъл в сравнение с жени с нормални нива на LH в кръвта (съответно 65% и 12% от спонтанните аборти). Вредният ефект на преждевременния пик на LH е свързан с преждевременно възобновяване на второто мейотично делене и овулация на незряла яйцеклетка, както и с индуциране на производството на андрогени от тека клетките, заедно с нарушена ендометриална рецепция под влияние на гестагенна недостатъчност. Въпреки това, предварителното намаляване на преовулаторните нива на LH с агонисти на гонадотропин-освобождаващия хормон без допълнителни мерки, насочени към удължаване на последващата бременност, не осигурява очакваното намаляване на честотата на спонтанните аборти.
Златният стандарт за диагностициране на НЛФ е хистологичното изследване на материал, получен от ендометриална биопсия във втората фаза на цикъла в продължение на 2 менструални цикъла.
Диагностицирането на други причини за овулаторна дисфункция, като хиперпролактинемия, хипотиреоидизъм, функционален излишък на андрогени (яйчникови или надбъбречни), трябва да бъде придружено от предписване на подходящо лечение.
Диагностика
Анамнеза и физикален преглед
- Анамнеза. Фактори, които трябва да се вземат предвид: късна менструация, нередовен менструален цикъл (олигоменорея, аменорея, внезапно покачване на тегло, загуба на тегло, безплодие, обичайни ранни спонтанни аборти).
- Преглед: тип на тялото, ръст, телесно тегло, хирзутизъм, тежест на вторичните полови белези, наличие на стрии, изследване на млечните жлези за галакторея.
- Функционални диагностични тестове: измерване на ректалната температура по време на 3 менструални цикъла.
Специални методи на изследване
- Хормонално изследване:
- в 1-ва фаза на менструалния цикъл (7–8-ми ден) – определяне на съдържанието на FSH, LH, пролактин, TSH, тестостерон, 17-хидроксипрогестерон (17-OP), DHEAS;
- във втората фаза на менструалния цикъл (21–22 дни) – определяне на съдържанието на прогестерон (нормативните показатели за нивата на прогестерон са много променливи, методът не може да се използва без отчитане на други фактори).
- Ултразвук:
- в 1-ва фаза на менструалния цикъл (5–7-ми ден) – диагноза на ендометриална патология, поликистозни яйчници;
- във втората фаза на менструалния цикъл (20–21 дни) – измерване на дебелината на ендометриума (нормално 10–11 мм, корелира със съдържанието на прогестерон).
- Ендометриална биопсия за потвърждаване на НЛФ се извършва 2 дни преди очакваната менструация (на 26-ия ден при 28-дневен цикъл). Този метод се използва в случаите, когато диагнозата е неясна. За изследване на промените в ендометриума в така наречения период на „имплантационен прозорец“ се извършва биопсия на 6-ия ден след овулацията.
Лечение
При диагностициране на НЛФ (според ректалните температурни диаграми, продължителността на втората фаза е по-малка от 11 дни, наблюдава се поетапно повишаване на температурата, недостатъчна секреторна трансформация на ендометриума според данните от ендометриална биопсия, ниски нива на прогестерон в кръвния серум) е необходимо да се установи причината за тези нарушения.
Ако НЛФ е съпроводена с хиперпролактинемия, се извършва ЯМР на мозъка. Алтернативен метод е рентгенова снимка на черепа (областта на турското седло).
Първият етап при хиперпролактинемия е изключването на аденом на хипофизата, което изисква хирургично лечение. При липса на значителни промени, хиперпролактинемията се счита за функционална и се предписва лечение с бромокриптин за нормализиране на нивата на пролактин. Началната доза бромокриптин е 1,25 mg/ден в продължение на 2 седмици, след проследяване на нивата на пролактин, ако показателите не се нормализират, дозата се увеличава до 2,5 mg/ден. При значително повишаване на нивата на пролактин, началната доза е 2,5 mg/ден. Ако настъпи бременност, приемът на бромокриптин трябва да се прекрати.
Ако се открие хипотиреоидизъм, естеството на патологията на щитовидната жлеза се определя съвместно с ендокринолог. Във всеки случай е показана ежедневна терапия с натриев левотироксин, като дозата се избира индивидуално, докато нивото на TSH се нормализира. Ако настъпи бременност, лечението с натриев левотироксин трябва да продължи. Въпросът за целесъобразността на увеличаване на дозата през първия триместър на бременността се решава съвместно с ендокринолог след получаване на резултатите от хормонално изследване (ниво на TSH, свободен тироксин).
Корекцията на НЛФ се извършва по един от два начина. Първият начин е стимулиране на овулацията, вторият начин е заместителна терапия с прогестеронови препарати.
Първият вариант за лечение е стимулиране на овулацията с кломифен цитрат. Този метод на лечение се основава на факта, че повечето нарушения на лутеалната фаза се развиват във фоликуларната фаза на цикъла. Постоянно намалените нива на прогестерон във втората фаза са следствие от нарушена фоликулогенеза в първата фаза на цикъла. Това нарушение ще бъде коригирано с по-голям успех чрез ниски дози кломифен цитрат в ранната фоликуларна фаза, отколкото чрез предписване на прогестерон във втората фаза на цикъла.
В първия цикъл дозата кломифен цитрат е 50 mg/ден от 5-ия до 9-ия ден от менструалния цикъл. Ефективността се следи с помощта на ректални температурни графики, измервания на нивата на прогестерон във втората фаза на цикъла или динамичен ултразвук. Ако няма достатъчен ефект във втория цикъл на стимулация на овулацията, дозата кломифен цитрат трябва да се увеличи до 100 mg/ден от 5-ия до 9-ия ден от цикъла. Максималната възможна доза в третия цикъл на стимулация на овулацията е 150 mg/ден. Такова увеличение на дозата е възможно само ако лекарството се понася добре (няма силна болка в долната част на корема и кръста и няма други признаци на овариална хиперстимулация).
Вторият вариант за лечение: заместителна терапия с прогестеронови препарати, които насърчават пълната секреторна трансформация на ендометриума, което дава необходимия ефект при пациенти с обичаен спонтанен аборт със запазена овулация. Освен това, през последните години е установено, че приложението на прогестеронови препарати има не само хормонален, но и имуномодулиращ ефект, потискайки реакциите на отхвърляне от имунокомпетентни клетки в ендометриума. По-специално, подобен ефект е описан за дихидрогестерон в доза от 20 mg/ден. За целите на заместителната терапия се използва дидрогестерон в доза от 20 mg/ден перорално или микронизиран прогестерон вагинално в доза от 200 mg/ден. Лечението се провежда на втория ден след овулацията (денят след повишаването на ректалната температура) и продължава 10 дни. Ако настъпи бременност, лечението с прогестеронови препарати трябва да продължи.
Съвременните изследвания не са потвърдили ефективността на човешкия хорионгонадотропин при лечението на повтарящи се спонтанни аборти.
При хиперандрогенизъм (яйчников или надбъбречен генезис) при пациенти с обичаен спонтанен аборт е показано лекарствено лечение поради ефекта на андрогените върху пълнотата на овулацията и състоянието на ендометриума. В случай на нарушение на биосинтеза на надбъбречни андрогени е възможен техният вирилизиращ ефект върху женския плод, поради което стероидната терапия се провежда в интерес на плода.
Хиперандрогенизъм на яйчников генезис (поликистозни яйчници)
Анамнеза, физикален преглед и резултати от специални изследвания
- Анамнеза: късна менархе, нарушения на менструалния цикъл като олигоменорея (обикновено първична, по-рядко вторична). Бременностите са редки, обикновено спонтанно прекъсвани през първия триместър, с дълги периоди на безплодие между бременностите.
- Преглед: хирзутизъм, акне, стрии, висок индекс на телесна маса (по избор).
- Графики на ректалната температура: ановулаторни цикли се редуват с цикли с овулация и НЛФ.
- Хормонално изследване: високи нива на тестостерон, нивата на FSH и LH могат да бъдат повишени, съотношението LH/FSH е по-голямо от 3. Ултразвук: поликистозни яйчници.
Лечение
Нелекарствено лечение
Отслабване - диетична терапия, физическа активност.
Лечение с наркотици
- Орлистат в доза от 120 mg с всяко основно хранене. Продължителността на курса се определя, като се вземат предвид ефектът и поносимостта.
- Предварително намаляване на тестостерона с препарати, съдържащи ципротерон ацетат (2 mg) и EE (35 mcg) в продължение на 3 менструални цикъла.
- Прекратяване на контрацепцията, хормонална поддръжка на втората фаза на цикъла (гестагенна терапия) - дидрогестерон в доза 20 mg/ден от 16-ия до 25-ия ден от менструалния цикъл. Ако няма спонтанна овулация, се преминава към следващия етап.
- Стимулиране на овулацията с кломифен цитрат в начална доза от 50 mg/ден от 5-ия до 9-ия ден от менструалния цикъл с едновременна терапия с гестагени (дидрогестерон в доза 20 mg/ден от 16-ия до 25-ия ден от цикъла) и дексаметазон (0,5 mg).
- При липса на бременност, дозата на кломифен цитрат се увеличава до 100–150 mg/ден с прилагане на гестагени във втората фаза на цикъла и дексаметазон (0,5 mg). Установено е, че въпреки че дексаметазонът само намалява нивото на надбъбречните андрогени, овулацията и зачеването настъпват значително по-често при лечение с кломифен цитрат и дексаметазон, отколкото при употреба само на кломифен цитрат [12].
- Провеждат се три цикъла на стимулация на овулацията, след което се препоръчва прекъсване от три менструални цикъла с гестагенна подкрепа и вземане на решение за хирургично лечение с помощта на лапароскопски достъп (клиновидна резекция на яйчниците, лазерна вапоризация).
По-нататъшно лечение на пациента
Лечението на бременността трябва да бъде съпроводено с гестагенна подкрепа до 16-та седмица от бременността (дидрогестерон в доза 20 mg/дневно или микронизиран прогестерон в доза 200 mg/дневно), дексаметазон се предписва само през първия триместър на бременността. Мониторингът е задължителен за навременна диагностика на истмико-цервикална недостатъчност и, ако е необходимо, нейната хирургична корекция.
Адренален хиперандрогенизъм (пубертетен и постпубертетен адреногенитален синдром)
Адреногениталният синдром (АГС) е наследствено заболяване, свързано с нарушаване на синтеза на хормони на надбъбречната кора поради увреждане на гени, отговорни за синтеза на редица ензимни системи. Заболяването се унаследява по автозомно-рецесивен начин с предаване на мутантни гени от двамата родители, които са здрави носители.
В 90% от случаите адреногениталният синдром се причинява от мутации в гена CYP21B, което води до нарушаване на синтеза на 21-хидроксилаза.
Анамнеза, физикален преглед и резултати от специални изследвания
- Анамнеза: късна менархе, леко удължен менструален цикъл, възможна олигоменорея, спонтанни аборти през първия триместър, възможно безплодие.
- Преглед: акне, хирзутизъм, андроиден тип тяло (широки рамене, тесен таз), хипертрофия на клитора.
- Графики на ректалната температура: ановулаторни цикли се редуват с цикли с овулация и НЛФ.
- Хормонален тест: високи нива на 17-OP, DHEAS.
- Ултразвук: яйчниците са непроменени.
Патогномоничен признак извън бременността е повишаване на концентрацията на 17-OP в кръвната плазма.
В момента за диагностициране на латентната, некласическа форма на надбъбречна хиперандрогения се използва тест с АКТХ. За този тест се използва Синактен - синтетичен полипептид, който притежава свойствата на ендогенен АКТХ, т.е. стимулира началните фази на синтеза на стероидни хормони от холестерол в надбъбречните жлези.
Синактен тест (аналог на ACTH): 1 ml (0,5 mg) синактен се инжектира подкожно в рамото, първоначалното съдържание на 17-OP и кортизол се определя първо в сутрешната 9-часова проба от кръвна плазма. Контролна кръвна проба се взема 9 часа след инжектирането, за да се определи нивото на 17-OP и кортизол. Индексът на определяне (D) след това се изчислява по формулата:
D = 0,052 × 17-OP + 0,005 × Кортизол/17-OP - 0,018 × Кортизол/17-OP
Ако коефициентът D е по-малък или равен на 0,069, това показва липса на надбъбречна хиперандрогения. Ако коефициентът D е по-голям от 0,069, трябва да се има предвид, че хиперандрогенизмът е причинен от дисфункция на надбъбречните жлези.
Лечение с наркотици
Основното лечение за хиперандрогенизъм, дължащ се на дефицит на 21-хидроксилаза, са глюкокортикоидите, които се използват за потискане на излишната секреция на андрогени.
По-нататъшно лечение на пациента
Поради вирилизиращия ефект на майчините андрогени върху плода, при установена диагноза надбъбречен хиперандрогенизъм, лечение с дексаметазон в начална доза от 0,25 mg се предписва преди бременност и продължава в индивидуално подбрана доза (от 0,5 до 1 mg) през цялата бременност. При жена с обичаен спонтанен аборт, страдаща от надбъбречен хиперандрогенизъм, е неподходящо да се отменя лечението, тъй като честотата на спонтанните аборти при липса на лечение достига 14%, а при продължаване - 9%.
Като се има предвид фактът, че пациентите с адреногенитален синдром могат да предадат този ген на плода, е необходимо провеждане на пренатална диагностика: на 17-18 гестационна седмица се предписва кръвен тест за определяне на съдържанието на 17-OP в майката. Ако нивото на хормона в кръвта е повишено, се определя концентрацията му в околоплодната течност. Ако съдържанието на 17-OP в околоплодната течност е повишено, се диагностицира адреногенитален синдром при плода. За съжаление, е невъзможно да се определи тежестта на адреногениталния синдром (лека или тежка форма със загуба на сол) по нивото на 17-OP в околоплодната течност. Въпросът за запазване на бременността в тази ситуация се решава от родителите.
Ако бащата на детето е носител на гена на адреногениталния синдром и в семейството са регистрирани случаи на деца, родени с този синдром, тогава пациентът, дори без надбъбречна хиперандрогения, получава дексаметазон в интерес на плода (за предотвратяване на вирилизация на женския плод) в доза от 20 mcg/kg телесно тегло, максимум 1,5 mg/ден в 2-3 дози след хранене. На 17-18 седмица, след определяне на пола на плода и експресията на гена на адреногениталния синдром (въз основа на резултатите от амниоцентеза), лечението продължава до края на бременността, ако плодът е момиче с адреногенитален синдром. Ако плодът е момче или момиче, което не е носител на гена на адреногениталния синдром, приемът на дексаметазон може да бъде спрян.
Ако жена с обичаен спонтанен аборт страда от надбъбречна хиперандрогения, лечението с дексаметазон се провежда през цялата бременност и се прекратява едва след раждането. На 3-тия ден след раждането дозата на дексаметазон се намалява постепенно (с 0,125 mg на всеки 3 дни) до пълното му спиране в следродилния период.
Хиперандрогенизъм със смесен генезис (яйчников и надбъбречен)
Анамнеза, физикален преглед и резултати от специални изследвания
- Анамнеза: късна менархе, нарушения на менструалния цикъл като олигоменорея (обикновено първична, по-рядко вторична), аменорея, възможни травми, сътресения. Бременностите са редки, обикновено спонтанно прекъсвани през първия триместър, дълги периоди на безплодие между бременностите.
- Физикален преглед: хирзутизъм, акне, стрии, акантоза нигриканс, висок индекс на телесна маса, хипертония.
- Графики на ректалната температура: ановулаторни цикли се редуват с цикли с овулация и НЛФ.
- Хормонално изследване: високи нива на тестостерон, нивата на FSH и LH могат да бъдат повишени, съотношение LH/FSH по-голямо от 3, високи нива на DHEAS, 17-OP, може да е налице хиперпролактинемия.
- Ултразвук: поликистозни яйчници.
- Електроенцефалография: промени в биоелектричната активност на мозъка.
- Хиперинсулинемия, нарушение на липидния метаболизъм (висок холестерол, липопротеини с ниска плътност и липопротеини с много ниска плътност), намален глюкозен толеранс или повишени нива на кръвната захар.
Лечение
Нелекарствено лечение
Загуба на тегло (нискокалорична диета, физическа активност).
Лечение с наркотици
Първият етап - при наличие на инсулинова резистентност се препоръчва предписване на метформин в дневна доза от 1000-1500 mg за повишаване на инсулиновата чувствителност.
Вторият етап - при тежки нарушения на менструалния цикъл и високи нива на тестостерон се препоръчва предписване на лекарства с антиандрогенен ефект, съдържащи ципротерон ацетат (2 mg) и етинилестрадиол (35 mcg) в продължение на 3 месеца.
Третият етап е стимулиране на овулацията, последвано от гестагенна подкрепа (схемата е описана по-горе) и прием на дексаметазон в дневна доза от 0,25–0,5 mg.
В случай на хиперпролактинемия и хипотиреоидизъм, трябва да се извърши подходяща корекция на лекарството в циклите за стимулиране на овулацията. Ако настъпи бременност, приемът на бромокриптин трябва да се прекрати и приемът на левотироксин да продължи.
Ако стимулацията на овулацията е неефективна, трябва да се реши въпросът за предписване на директни индуктори на овулацията, целесъобразността на хирургично лечение на поликистозни яйчници или ин витро оплождане.
По-нататъшно лечение на пациента
При пациенти с метаболитен синдром бременността често се усложнява от артериална хипертония, нефропатия, хиперкоагулация, във връзка с което е необходимо да се следи кръвното налягане, хемостазиограмите от ранните етапи на бременността и да се коригират възникващите нарушения (ако е необходимо) с антихипертензивни лекарства, антитромбоцитни средства и антикоагуланти. Гестагенни лекарства се предписват до 16-та седмица от бременността - дидрогестерон в доза 20 mg/ден или микронизиран прогестерон в доза 200 mg/ден в 2 дози.
Всички жени с хиперандрогенизъм представляват рискова група за развитие на истмично-цервикална недостатъчност. Мониторингът на състоянието на шийката на матката трябва да се провежда от 16-та седмица на бременността, ако е необходимо - хирургична корекция на истмично-цервикалната недостатъчност.
Имунологични причини за обичаен спонтанен аборт
Понастоящем е известно, че около 80% от всички необясними досега случаи на повторна загуба на бременност (след изключване на генетични, анатомични, хормонални причини) са свързани с имунни нарушения. Разграничават се автоимунни и алоимунни нарушения, водещи до обичаен спонтанен аборт.
При автоимунните процеси собствените тъкани на имунната система стават обект на агресия, т.е. имунният отговор е насочен срещу собствените антигени. В тази ситуация плодът страда вторично в резултат на увреждане на тъканите на майката.
При алоимунни заболявания имунният отговор на жената е насочен срещу ембрионални/фетални антигени, получени от бащата и които са потенциално чужди за тялото на майката.
Автоимунните заболявания, които най-често се срещат при пациенти с обичаен спонтанен аборт, включват наличието на антифосфолипидни, антитироидни и антинуклеарни автоантитела в серума. Така е установено, че 31% от жените с обичаен спонтанен аборт извън бременността имат автоантитела към тиреоглобулин и тироидна пероксидаза (тироидни микрозомни [тироидна пероксидаза] автоантитела); в тези случаи рискът от спонтанен спонтанен аборт през първия триместър на бременността се увеличава до 20%. При обичаен спонтанен аборт наличието на антинуклеарни и антитироидни антитела показва необходимостта от допълнително изследване за идентифициране на автоимунния процес и потвърждаване на диагнозата.
Антифосфолипидният синдром (АФС) остава общопризнато автоимунно заболяване, водещо до ембрионална/фетална смърт.
Алоимунни нарушения
В момента алоимунните процеси, водещи до отхвърляне на плода, включват наличието на увеличен (повече от 3) брой общи антигени от основната система за хистосъвместимост при съпрузите (често наблюдавани при кръвни бракове); ниски нива на блокиращи фактори в серума на майката; повишени нива на естествени клетки убийци (NK клетки CD56, CD16) в ендометриума и периферната кръв на майката както извън, така и по време на бременност; високи нива на концентрация на редица цитокини в ендометриума и кръвния серум, по-специално γ-интерферон, тумор некрозисен фактор а, интерлевкини-1 и 2.
В момента алоимунните фактори, водещи до ранни сривове на бременността, и начините за коригиране на гореспоменатите състояния са в процес на проучване. Няма консенсус относно методите на терапия. Според някои изследователи активната имунизация с донорски лимфоцити не води до значителен ефект, докато други автори описват значителен положителен ефект при такава имунизация и лечение с имуноглобулини.
В момента един от имуномодулиращите агенти в ранна бременност е прогестеронът. По-специално, проучванията са доказали ролята на дидрогестерон в дневна доза от 20 mg при жени с обичаен спонтанен аборт през първия триместър на бременността с повишено ниво на CD56 клетки в ендометриума.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Генетично обусловени тромбофилии
Следните форми на генетично обусловени тромбофилии се считат за тромбофилни състояния по време на бременност, водещи до обичаен спонтанен аборт.
- Дефицит на антитромбин III.
- Мутация на фактор V (мутация на Лайден).
- Дефицит на протеин С.
- Дефицит на протеин S.
- Мутация на протромбиновия ген G20210A.
- Хиперхомоцистеинемия.
Изследване за идентифициране на редки причини за тромбофилия е необходимо в случаите, когато е имало:
- фамилна анамнеза - тромбоемболизъм преди 40-годишна възраст при роднини;
- достоверни епизоди на венозна и/или артериална тромбоза преди 40-годишна възраст;
- повтаряща се тромбоза при пациента и близки роднини;
- тромбоемболични усложнения по време на бременност и след раждане при използване на хормонална контрацепция;
- многократни спонтанни аборти, мъртвораждания, вътрематочно забавяне на растежа, отлепване на плацентата;
- ранна прееклампсия, HELLP синдром.
Инфекциозни причини за обичаен спонтанен аборт
Ролята на инфекциозния фактор като причина за обичайни спонтанни аборти в момента е обект на широки дебати. Известно е, че първичната инфекция в ранните етапи на бременността може да причини увреждане на ембриона, несъвместимо с живота, което води до спорадични спонтанни аборти. Вероятността от реактивиране на инфекцията едновременно с резултата от многократни спонтанни аборти обаче е незначителна. Освен това, понастоящем не са открити микроорганизми, които провокират обичайни спонтанни аборти. Проучвания през последните години показват, че повечето жени с обичайни спонтанни аборти и хроничен ендометрит имат разпространение на 2-3 или повече вида облигатни анаеробни микроорганизми и вируси в ендометриума.
Според В. М. Сиделникова и др., при жени, страдащи от обичаен спонтанен аборт, диагнозата хроничен ендометрит извън бременността е хистологично потвърдена в 73,1% от случаите, а в 86,7% е наблюдавана персистираща вирусна инфекция в ендометриума, което със сигурност може да е причина за активиране на имунопатологични процеси. Смесена персистираща вирусна инфекция (вирус на херпес симплекс, Коксаки А, Коксаки В, ентеровируси 68–71, цитомегаловирус) се открива при пациенти с обичаен спонтанен аборт значително по-често, отколкото при жени с нормална акушерска анамнеза. К. Кохут и др. (1997) показват, че процентът на възпалителни промени в ендометриума и децидуалната тъкан при пациенти с първичен приципиален спонтанен аборт е значително по-висок, отколкото при жени след спонтанен аборт с анамнеза за поне едно доносено раждане.
Бактериалната и вирусна колонизация на ендометриума обикновено е резултат от неспособността на имунната система и неспецифичните защитни сили на организма (комплементната система, фагоцитоза) да елиминират напълно инфекциозния агент, като същевременно разпространението му е ограничено от активирането на Т-лимфоцитите (Т-хелпери, естествени убийци) и макрофагите. Във всички горепосочени случаи се наблюдава персистиране на микроорганизми, характеризиращо се с привличане на мононуклеарни фагоцити, естествени убийци, Т-хелпери, синтезиращи различни цитокини, към мястото на хроничното възпаление. Очевидно такова състояние на ендометриума предотвратява създаването на локална имуносупресия в преимплантационния период, която е необходима за формиране на защитна бариера и предотвратяване на отхвърлянето на получужд плод.
В тази връзка, преди бременност, жените с обичайни спонтанни аборти трябва да бъдат диагностицирани с хроничен ендометрит. За да се установи или изключи тази диагноза, се извършва ендометриална биопсия на 7-8-ия ден от менструалния цикъл с хистологично изследване, PCR и бактериологично изследване на материала от маточната кухина. При потвърждаване на диагнозата, хроничният ендометрит се лекува съгласно стандартите за лечение на възпалителни заболявания на тазовите органи.

