Нови публикации
Учените откриват нов имуносупресивен механизъм при рак на мозъка
Последно прегледани: 02.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Доцент Филипо Велия и неговият екип в Института Уистар са открили ключов механизъм, чрез който глиобластомът – сериозен и често фатален рак на мозъка – потиска имунната система, така че туморът да може да расте безпрепятствено от защитните сили на организма.
Тяхното откритие е публикувано в статията „Глюкозно-задвижваната хистонова лактилация насърчава имуносупресивната активност на макрофаги, получени от моноцити, в глиобластом“ в списание Immunity.
„Нашето проучване показва, че механизмите за самовъзпроизвеждане на рака, ако бъдат достатъчно разбрани, могат да бъдат използвани много ефективно срещу болестта“, каза д-р Велия.
„Очаквам с нетърпение бъдещи изследвания на механизмите за имуносупресия, медиирани от метаболизма, при глиобластом и се надявам, че ще продължим да научаваме повече за това как да разберем по-добре и да се борим с този рак.“
Досега малко е проучено как макрофагите и микроглията, получени от моноцити, създават имуносупресивна туморна микросреда в глиобластома.
Лабораторията „Веглия“ изследва клетъчните механизми на имуносупресията при глиобластом и установява, че с напредването на глиобластома, макрофагите, получени от моноцити, започват да превъзхождат микроглията, което предполага, че преобладаването на макрофаги, получени от моноцити, в туморната микросреда е благоприятно за рака по отношение на избягването на имунната защита.
Всъщност, макрофагите, получени от моноцити, но не и микроглията, блокираха активността на Т-клетките (имунни клетки, които убиват туморни клетки) в предклинични модели и при пациенти. Екипът потвърди това, като оцени предклинични модели на глиобластом с изкуствено намален брой макрофаги, получени от моноцити.
Както се очакваше, модели с по-малко злокачествени макрофаги в туморната микросреда показаха подобрени резултати в сравнение със стандартните модели на глиобластом.
Глиобластомът представлява малко над половината от всички злокачествени тумори, които възникват в мозъка, а прогнозата за пациенти, диагностицирани с болестта, е изключително лоша: само 25% от пациентите оцеляват през първата година след поставяне на диагнозата. Глиобластомът е опасен не само заради местоположението си в мозъка, но и заради имуносупресивната туморна микросреда, която прави глиобластома резистентен на обещаващи имунотерапии.
Чрез програмиране на определени имунни клетки, като макрофаги (макрофаги и микроглия, получени от моноцити), да работят за тумора, а не срещу него, глиобластомът създава туморна микросреда за себе си, която позволява на рака да расте агресивно, като същевременно избягва противораковите имунни отговори.
Изясняване на механизма
След като потвърди ролята на макрофагите, получени от моноцити, лабораторията на Веглия се опита да разбере как точно тези свързани с рака имунни клетки работят срещу имунната система.
Те секвенирали макрофагите, за да определят дали клетките имат някакви анормални модели на генна експресия, които биха могли да показват гени, играещи роля в имуносупресията, а също така изследвали метаболитните модели на макрофагите, за да видят дали анормалната генна експресия е свързана с метаболизма.
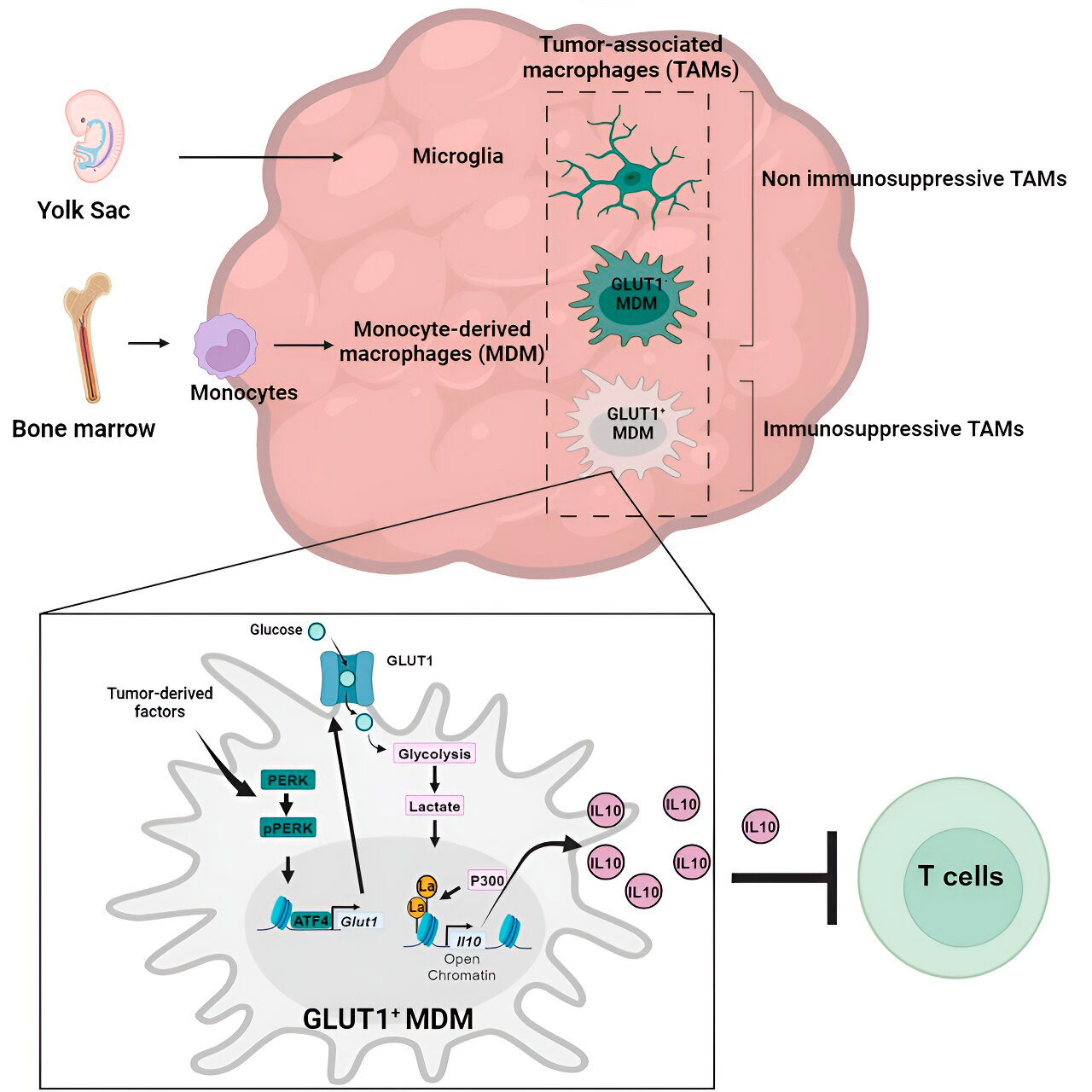
Генният и метаболитен анализ ги насочи към метаболизма на глюкозата. Серия от тестове показа, че макрофагите, получени от моноцити, с повишен метаболизъм на глюкозата и експресия на GLUT1, основният транспортер на глюкоза, блокират функцията на Т-клетките чрез освобождаване на интерлевкин-10 (IL-10).
Екипът демонстрира, че глиобластомът нарушава метаболизма на глюкозата в тези макрофаги, причинявайки тяхната имуносупресивна активност.
Лактилиране на хистони и неговата роля
Изследователите открили, че ключът към имуносупресивната активност, свързана с метаболизма на глюкозата, на макрофагите, получени от моноцити, се крие в процес, наречен „хистонова лактилация“. Хистоните са структурни протеини в генома, които играят ключова роля в експресията на гени като IL-10 в определени контексти.
Чрез бързо метаболизиране на глюкозата, макрофагите, получени от моноцити, произвеждат лактат, страничен продукт от метаболизма на глюкозата. Хистоните могат да станат „лактилирани“ (т.е. лактатът се интегрира в хистоните) по такъв начин, че организацията на хистоните насърчава експресията на IL-10, който се произвежда от макрофаги, получени от моноцити, за да подпомогне растежа на раковите клетки.
Решение на проблема
Но как може да се спре имуносупресивната активност на макрофагите, получени от моноцити, свързана с метаболизма на глюкозата? Д-р Велия и неговият екип идентифицираха възможно решение: PERK, ензим, който те идентифицираха като регулатор на метаболизма на глюкозата и експресията на GLUT1 в макрофагите.
В предклинични модели на глиобластом, насочването към PERK нарушава хистоновата лактилация и имуносупресивната активност на макрофагите, а когато се комбинира с имунотерапия, блокира прогресията на глиобластома и индуцира дългосрочен имунитет, който защитава мозъка от повторен растеж на тумора, което предполага, че насочването към оста PERK-хистонова лактилация може да бъде жизнеспособна стратегия за борба с този смъртоносен рак на мозъка.
