Нови публикации
Проучването подчертава необходимостта от специфични за клетъчния тип терапии за ХИВ
Последно прегледани: 02.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Изследователи от Университета на Илинойс демонстрираха важността на насочването към специфични типове клетки при лечението на ХИВ. Тяхното проучване, публикувано в списанието Proceedings of the National Academy of Sciences, е едно от първите, които разглеждат диференциалните или специфични за клетъчния тип ефекти на модулацията на латентността на ХИВ върху миелоидните клетки, вид имунни клетки, произвеждани в костния мозък.
Една от основните пречки пред елиминирането на ХИВ инфекцията е управлението на латентността или периода, през който заразената клетка е в латентно състояние и не може да произвежда вирус. Латентните ХИВ клетки се събират в тялото на места, известни като резервоари. Латентните резервоари са проблематични, защото могат да започнат да произвеждат вирус по всяко време.
Пълното ерадикиране на заболяването би изисквало отстраняването на всички латентни клетки от тялото или трайна резистентност към активиращи стимули. Реактивирането обаче може да бъде предизвикано от различни фактори, включително сигнали, които насочват диференциацията на миелоидните клетки.
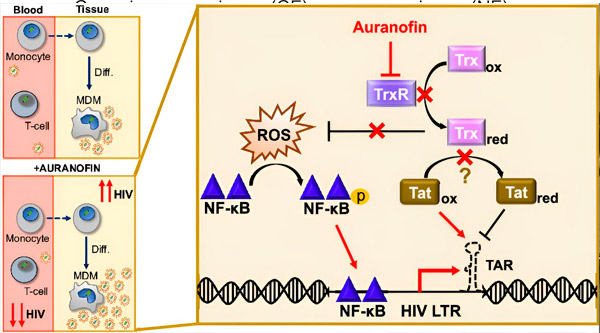
Регулирането на латентността на HIV в макрофаги, получени от моноцити (MDM), може да представлява риск за разпространение на вируса. Диференциацията на моноцити в макрофаги може да предизвика реактивиране на HIV, потенциално насърчавайки разпространението на вируса в тъканите (горе вляво). Клиничен кандидат, Auranofin, намалява вирусната ДНК в кръвта и насърчава латентността на HIV в Т-клетките и моноцитите, но причинява реактивиране на HIV в MDM (долу вляво). При MDM предполагаме, че инхибирането на TrxR от Auranofin води до натрупване на реактивни кислородни видове (ROS), което индуцира активиране на NF-κB и активиране на HIV LTR промотора (вдясно). Инхибирането на TrxR потенциално намалява редукцията на субстрата, позволявайки на Tat протеина да остане преференциално окислен, където може да се свърже с TAR и да инициира HIV транскрипция. Източник: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
В продължение на години изследванията за лечение на ХИВ се съсредоточават около два подхода, известни като „шок и убиване“ и „блокиране и заключване“. Първият действа в комбинация с антиретровирусна терапия, за да активира латентно инфектираните клетки и да ги убие чрез апоптоза или програмирана клетъчна смърт, докато вторият принуждава инфектираните клетки да влязат в дълбоко латентно състояние, от което не могат да се реактивират сами.
Изследванията около тези техники традиционно са фокусирани върху вид бели кръвни клетки, наречени Т-клетки, които са основната цел на HIV инфекцията. Латентните резервоари обаче са съставени от нещо повече от Т-клетки; всъщност те съдържат десетки различни клетъчни типове, всеки със свои собствени уникални модели на HIV генна експресия.
„Има огромно разнообразие от клетки, дори в рамките на една линия“, каза Колин Кийфър, доцент по микробиология и автор на статията. „Променливостта на реакцията в тези резервоари се увеличава с всеки нов клетъчен тип.“
Александра Бланко, докторант в лабораторията на Кийфър, искала да изучава клетъчни типове, които са били пропуснати в традиционните изследвания на ХИВ. Фокусирайки се върху миелоидни клетки, тя създава библиотека от клонове, съдържаща 70 популации от латентно инфектирани моноцити. След това Бланко анализира клоналните популации и техните реакции към активиране. Реакциите варират значително, което подчертава голямото разнообразие в рамките на един клетъчен тип.
Това наблюдение повдигна нов въпрос: наистина ли различните типове клетки имат различни отговори на лечението на латентност на ХИВ? Всъщност техните открития показват, че някои терапии за латентност на ХИВ могат да стимулират латентността в Т-клетките и моноцитите, докато могат да обърнат латентността в макрофагите.
„Не всички клетки в тялото са еднакви“, каза Кийфър. „Така че е логично, че не всички заразени клетки ще реагират на вируса по един и същи начин.“
Тяхната статия подчертава необходимостта бъдещите лечения за ХИВ да вземат предвид всички типове клетки и как всяка клетка може да реагира на потенциални терапии.
Техните открития се основават на изследвания на Рой Дар, бивш професор по биоинженерство в Илинойс, чиято лаборатория е изучавала хетерогенността в генната експресия на HIV.
„Той го започна, а ние го поехме и го развихме до мястото, където е днес“, каза Кийфър. „Така че сътрудничеството наистина даде тласък на тези резултати. То се превърна в нова посока за нашата лаборатория и ние сме наистина развълнувани от това.“
Допълнително и неочаквано откритие от анализа на Бланко разкрива промени в размера и формата на клетките в отговор на инфекция, което предполага, че ХИВ може да промени клетъчната морфология. Следващата цел на Бланко е да идентифицира биологичните механизми, лежащи в основата на тези фенотипни промени.
Кийфър и членовете на неговата лаборатория също очакват с нетърпение да възпроизведат резултатите си, които са направени предимно в клетъчна линия, в първични клетки. Възпроизвеждането на резултатите в модел, по-подобен на човек, би подобрило клиничната значимост на изследването, обясни Кийфър.
„Бихме искали да направим по-големи скринингови изследвания в Т-клетки, моноцити и макрофаги, за да идентифицираме потенциални лекарства, които биха могли да действат върху всички тези типове клетки“, каза Бланко. „Може да открием още повече молекули, които не се държат по специфичен за клетъчния тип начин.“
