Нови публикации
Мутацията на гена ARID1A прави туморите чувствителни към имунотерапия
Последно прегледани: 02.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Имунотерапията революционизира лечението на рака през последните години. Вместо директно насочване към туморите, имунотерапията насочва имунната система на пациентите да атакува туморите по-ефективно. Това е особено ефективно при някои труднолечими видове рак. Въпреки това, по-малко от половината от всички пациенти с рак реагират на съвременните имунотерапии, което създава спешна необходимост от идентифициране на биомаркери, които могат да предскажат кои пациенти е най-вероятно да се повлияят добре от лечението.
Наскоро учените забелязаха, че пациенти, чиито тумори имат мутация в гена ARID1A, са по-склонни да реагират положително на блокада на имунните контролни точки - вид имунотерапия, която действа чрез поддържане на активирани имунни клетки, борещи се с рака.
Тъй като мутацията в гена ARID1A присъства в много видове рак, включително рак на ендометриума, яйчниците, колоректалния рак, стомаха, черния дроб и панкреаса, изследователите от Института Salk се чудеха как тя може да допринесе за чувствителността на лечението и как клиницистите биха могли да използват тази информация, за да персонализират лечението на рака за всеки пациент.
Новото им проучване, публикувано в списание Cell, показва, че мутацията ARID1A прави туморите чувствителни към имунотерапия, като привлича имунни клетки, борещи се с рака, към тумора чрез антивирусен имунен отговор.
Изследователите предполагат, че тази мутация и антивирусният имунен отговор биха могли да се използват като биомаркер за по-добър подбор на пациенти за специфични имунотерапии, като например блокиране на имунни контролни точки. Тези открития също така насърчават разработването на лекарства, насочени към ARID1A и свързани протеини, за да направят други тумори по-чувствителни към имунотерапия.
„Това наистина би могло да промени резултата от лечението на рака при пациентите“, каза доцент Даяна Харгрийвс, старши автор на изследването. „Пациентите с мутацията ARID1A вече имат имунен отговор, така че всичко, което трябва да направим, е да го засилим с блокиране на имунните контролни точки, за да им помогнем да унищожат туморите си отвътре.“
Въпреки че е било известно, че хората с ARID1A мутации реагират добре на блокиране на имунните контролни точки, точната връзка между двете остава неясна. За да хвърлят светлина върху механизма, учените от Института Salk са използвали миши модели на меланом и колоректален рак както с ARID1A мутацията, така и с функционален ARID1A.
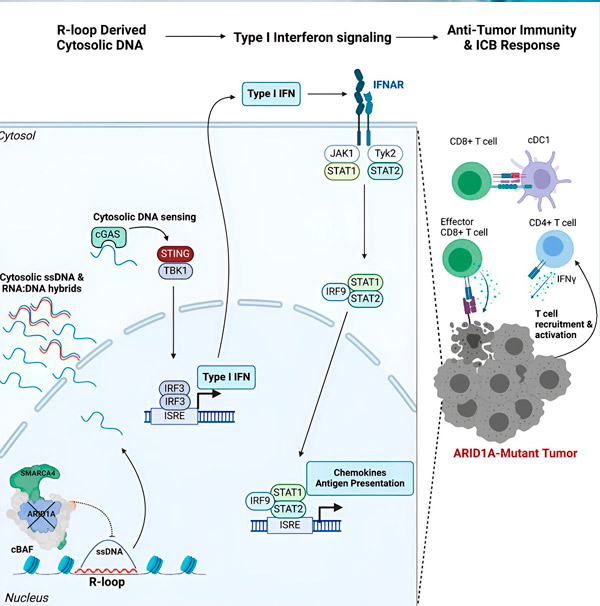
Източник: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Екипът наблюдава силен имунен отговор във всички модели с мутацията ARID1A, но не и в тези, където ARID1A е функционална, което подкрепя идеята, че мутацията ARID1A наистина задвижва този отговор. Но как работи това на молекулярно ниво?
„Открихме, че ARID1A играе важна роля в ядрото, като поддържа правилната организация на ДНК“, казва Матю Максуел, първи автор на изследването и докторант в лабораторията Харгрийвс. „Без функционален ARID1A, свободната ДНК може да бъде изрязана и освободена в цитозола, активирайки желан антивирусен имунен отговор, който може да бъде засилен чрез блокиране на имунните контролни точки.“
Генът ARID1A кодира протеин, който помага за регулиране на формата на нашата ДНК и поддържане на стабилността на генома. Когато ARID1A мутира, той задейства верига от събития, подобна на тази на Рубе Голдбърг, в раковите клетки.
Първо, липсата на функционален ARID1A води до освобождаване на ДНК в цитозола. След това цитозолната ДНК активира антивирусна алармена система, cGAS-STING пътя, защото нашите клетки са адаптирани да маркират всяка ДНК в цитозола като чужда, за да се предпазят от вирусни инфекции. В крайна сметка, cGAS-STING пътят ангажира имунната система да привлече Т-клетки към тумора и да ги активира в специализирани ракови Т-клетки убийци.
На всяка стъпка, в зависимост от предишната, тази верига от събития – мутация на ARID1A, излизане на ДНК, cGAS-STING аларма, набиране на Т-клетки – води до увеличаване на броя на Т-клетките, борещи се с рака, в тумора. Блокадата на имунните контролни точки може да се използва, за да се гарантира, че тези Т-клетки остават активирани, повишавайки способността им да побеждават рака.
„Нашите открития предоставят нов молекулярен механизъм, чрез който мутацията на ARID1A може да допринесе за противотуморен имунен отговор“, казва Харгрийвс. „Вълнуващото в тези открития е техният транслационен потенциал. Можем да използваме мутациите на ARID1A, за да селектираме пациенти за блокиране на имунните контролни точки и сега виждаме механизъм, чрез който лекарства, които инхибират ARID1A или неговия протеинов комплекс, биха могли да се използват за допълнително засилване на имунотерапията при други пациенти.“
Чрез описание на механизма, чрез който блокадата на имунните контролни точки е по-ефективна при ракови заболявания с ARID1A мутация, изследователите предоставят на клиницистите обосновка за приоритизиране на тази имунотерапия при пациенти с ARID1A мутация. Тези открития са важна стъпка към персонализиране на лечението на рака и вдъхновяват разработването на нови терапии, насочени към ARID1A и неговия протеинов комплекс.
В бъдеще екипът на Института Салк се надява, че техните открития ще подобрят резултатите от лечението на пациенти с различни видове рак, свързани с мутации в ARID1A, и възнамерява да проучи това клинично приложение в сътрудничество с Калифорнийския университет в Сан Диего.
