Нови публикации
Идентифициран е ключов протеин, който предотвратява загубата на костна маса при остеопороза
Последно прегледани: 02.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
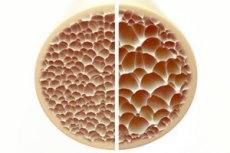
Остеопорозата, състояние, характеризиращо се с порести и крехки кости, представлява сериозна заплаха за здравето на скелета. Костите, като основна структурна опора на човешкото тяло, осигуряват жизненоважна опора. Когато костната маса намалява, това не само нарушава тази опора, но и нарушава цялостната функция, което води до намалено качество на живот.
С увеличаването на честотата на остеопорозата сред застаряващото население, нараства и тежестта върху здравните ресурси за дългосрочни грижи. Следователно е необходимо да се разберат механизмите, които допринасят за развитието на остеопороза, и да се разработят ефективни целенасочени лечения за минимизиране на дългосрочното ѝ въздействие.
Остеобластите и остеокластите са два вида клетки, които играят ключова роля в поддържането и ремоделирането на костната тъкан. Докато остеобластите са костно-образуващи клетки, отговорни за синтеза и отлагането на нова костна тъкан, остеокластите са костно-разграждащи клетки, участващи в разграждането и отстраняването на стара или увредена костна тъкан.
Увеличаването на дела на остеокластите води до костна загуба при състояния като остеопороза, ревматоиден артрит (възпаление на ставите) и костни метастази (рак, който се е разпространил в костите). Остеокластите възникват от диференциацията на макрофаги или моноцити, които са видове имунни клетки.
Следователно, инхибирането на диференциацията на остеокластите може да служи като терапевтична стратегия за предотвратяване на костна загуба. Въпреки това, точните молекулярни механизми, регулиращи сложния процес на костно ремоделиране, остават неясни.
В ново проучване, професор Тадайоши Хаята, г-н Такуто Коно и г-жа Хитоми Мурачи от Токийския университет на науките, заедно с колеги, се задълбочиха в молекулярната регулация на диференциацията на остеокластите. Стимулацията с лиганд на рецепторния активатор на ядрен фактор капа B (RANKL) индуцира диференциацията на макрофагите в остеокласти.
Освен това, сигналните пътища на костния морфогенетичен протеин (BMP) и трансформиращия растежен фактор (TGF)-β са замесени в регулирането на RANKL-медиираната диференциация на остеокластите. В настоящото проучване изследователите са си поставили за цел да изследват ролята на Ctdnep1, фосфатаза (ензим, който премахва фосфатни групи), за която е съобщено, че потиска сигналните пътища на BMP и TGF-β.
Изследването е публикувано в списанието Biochemical and Biophysical Research Communications.
Професор Хаята заявява: „RANKL действа като „ускорител“ за диференциацията на остеокластите. Шофирането на автомобил изисква не само газ, но и спирачки. Тук открихме, че Ctdnep1 действа като „спирачка“ при диференциацията на остеокластите.“
Изследователите първо изследвали експресията на Ctdnep1 в третирани с RANKL миши макрофаги и нетретирани контролни клетки. Те наблюдавали, че експресията на Ctdnep1 не се променя в отговор на RANKL стимулация. Въпреки това, тя е локализирана в цитоплазмата в гранулирана форма в макрофагите и се диференцира в остеокласти, различно от нормалната ѝ перинуклеарна локализация в други клетъчни типове, което показва цитоплазмената ѝ функция в диференциацията на остеокластите.
Освен това, нокдаунът на Ctdnep1 (понижаване на генната експресия) доведе до увеличаване на броя на остеокластите, позитивни за тартарат-резистентна киселинна фосфатаза (TRAP), където TRAP е маркер на диференцирани остеокласти.
Нокаутът на Ctdnep1 доведе до повишена експресия на ключови маркери за диференциация, включително "Nfatc1", главен транскрипционен фактор, индуциран от RANKL за диференциация на остеокластите. Тези резултати подкрепят "спирачната функция" на Ctdnep1, при която той негативно регулира диференциацията на остеокластите. Освен това, нокаутът на Ctdnep1 също доведе до повишена абсорбция на калциев фосфат, което предполага супресивна роля на Ctdnep1 в костната резорбция.
Накрая, въпреки че нокаутът на Ctdnep1 не промени BMP и TGF-β сигнализацията, клетките с дефицит на Ctdnep1 показаха повишени нива на фосфорилирани (активирани) протеини, които са продукти на RANKL сигналния път. Тези резултати предполагат, че инхибиторният ефект на Ctdnep1 върху диференциацията на остеокластите може да не се медиира чрез BMP и TGF-β сигнализацията, а чрез понижаване на RANKL сигналния път и нивата на Nfatc1 протеина.
Като цяло, тези резултати предоставят нова представа за процеса на диференциация на остеокластите и идентифицират потенциални терапевтични цели, които биха могли да бъдат използвани за разработване на лечения за намаляване на костната загуба, дължаща се на свръхактивност на остеокластите. В допълнение към заболяванията, характеризиращи се с костна загуба, Ctdnep1 е идентифициран и като причинителен фактор при медулобластом, детски мозъчен тумор. Авторите са оптимисти, че изследванията им могат да бъдат разширени до други човешки заболявания извън костния метаболизъм.
Професор Хаята заключава: „Нашите резултати показват, че Ctdnep1 е необходим за предотвратяване на прекомерната остеокластогенеза. Тези резултати могат допълнително да разширят познанията ни за това как мрежата за фосфорилиране-дефосфорилиране контролира диференциацията на остеокластите и могат да предоставят нови терапевтични стратегии за лечение на костни заболявания, свързани с прекомерна остеокластна активност.“
