Нови публикации
„Кислород за клетки“: прост имплант помогна за понижаване на нивата на захар без силни лекарства
Последно прегледани: 18.08.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
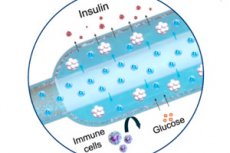
В Nature Communications беше описан нов „кислороден“ имплант за лечение на диабет тип 1: компактен електрохимичен генератор на кислород (iEOG) непрекъснато доставя O₂ към макрокапсула с инсулин-секретиращи клетки. Тази система позволява плътно опаковане на изолирани островчета (до 60 000 IEQ/ml) и поддържа тяхната жизнеспособност и секреция дори при условия на ниско съдържание на кислород. При плъхове с диабет устройството, имплантирано под кожата, поддържа нормална захар до три месеца - без имуносупресия. Контролните плъхове, без кислород, остават хипергликемични.
Предистория
- Основният технически проблем е кислородът. Веднага щом „скрием“ клетките зад мембраната и поставим устройството под кожата (удобно и лесно се извлича), те изпитват недостиг на кислород: дифузията през мембраната и слабо кръвоснабденото място не отговаря на нуждите на „ненаситните“ островчета. Оттук и ранната смърт, слабата работа и необходимостта от силно разреждане на засяването - в противен случай капсулата се оказва огромна.
- Защо е толкова физически трудно? Кислородът преминава през тъканите само на много кратки разстояния, а капсулираните клетки нямат собствени съдове - през първите месеци те живеят само благодарение на пасивна дифузия. Всяко удебеляване на материалите или „уплътняване“ на клетките бързо прехвърля центъра на капсулата в хипоксия.
- Какво сте опитвали преди?
- Те създадоха макроустройства с възможност за повторно пълнене с кислород (например βAir): вътре има резервоар, който се пълни с кислород ежедневно; имаше предклинични и ранни клинични изпитвания. Работи, но е трудоемко за пациента.
- Бяха изпробвани химически O₂ донори и „носещи“ материали (перфлуоросъединения): те помагат, но дават краткотраен и труден за контрол ефект. Появиха се и „въздушни“ рамки за ускоряване на доставянето на O₂ в дебелината на гела.
- Самите капсули и местата на имплантация (тънки мембрани, преваскуларизация) бяха подобрени, но без външен източник на O₂ те все още се сблъскват с ограниченията на клетъчната плътност.
- Каква празнина в пъзела запълва новата работа? Авторите на Nature Communications показват непрекъснато подаване на кислород от мини-генератор точно вътре в макрокапсулиращата система: устройството взема вода от тъканите и електрохимично освобождава O₂, който равномерно „диша“ по капсулата с клетки. Идеята е да се даде на капсулата „собствен аквариумен компресор“, така че да може да опакова повече клетки и въпреки това да ги поддържа живи и работещи – дори в подкожно, не много „оксигенирано“ място.
Защо изобщо е необходимо това?
Трансплантацията на островни клетки или бета-клетки е един от най-обещаващите пътища за „функционално лечение“ на диабет тип 1. Но има две основни пречки:
- Имунитет - обикновено изисква доживотни имуносупресори;
- Кислородно гладуване - капсули, които защитават имунната система, едновременно отрязват клетките от съдовете, а бета-клетките, ненаситни за O₂, бързо се „задушават“. Новото откритие достига втората бариера: то осигурява на капсулата собствен, контролиран източник на кислород.
Как работи имплантът
- Две части. В титаниев корпус има мини-генератор на кислород (iEOG), който извлича вода от интерстициалната течност и освобождава O₂ чрез електролиза; до него има тънка линейна капсула с клетки (подобна на дълга „наденица“), през която преминава газопропусклива тръба: кислородът се абсорбира равномерно по цялата капсула. Между клетките и тъканите има полупропусклива мембрана (електроспин + алгинат): глюкозата и инсулинът преминават, имунните клетки не.
- Размери: Втората версия на iEOG е с диаметър 13 мм и дебелина 3,1 мм, с тегло около 2 г. Когато се сдвоява с капсула, такава система може да се поставя и изважда през малък разрез, което е важно за безопасността.
- Производителност. Генераторът произвежда ~1,9–2,3 cm³ O₂/h и поддържа зададения поток в продължение на месеци и дори години (при дългосрочни тестове във физиологичен разтвор — до 2,5 години), а след имплантиране при плъхове това ниво се поддържа. Такъв поток е изчислен да покрие нуждите на стотици хиляди еквиваленти на островни клетки — от порядъка на величината, от която се нуждае човек.
Какво показаха експериментите
- In vitro: При 1% O₂ (тежка хипоксия), оксигенацията поддържа жизнеспособността и секрецията в INS-1 агрегатите и в човешките островни клетки, опаковани в много плътен слой (60 000 IEQ/mL).
- In vivo (плъхове). След подкожно имплантиране в алогенен модел на диабет, iEOG системата нормализира гликемията до 3 месеца без имуносупресия; устройства без кислород не показаха ефект. Хистологията около генератора не показа значителни нежелани реакции.
Защо това е важно за клиниката?
- Стъпка към „реалистични размери“. За да се осигури на възрастен доза от 300–770 хиляди IEQ, капсулата трябва да бъде плътно опакована – това винаги е било ограничено от кислорода. Контролираното подаване на O₂ „премахва тавана“ на плътността и дава възможност устройството да бъде достатъчно компактно за реална имплантация.
- Плюс удобство. Преди това опитахме химически донори на кислород (пероксиди) - те не действат дълго и са неконтролируеми, както и резервоари с O₂ с ежедневно „пълнене“ през кожата - тромави и неудобни. Тук кислородът се подава постоянно и в премерени дози, без инжекции.
Технически детайли, които впечатляват
- Източникът на вода е тъкан. iEOG поема парите на интерстициалната течност през порест „прозорец“, след което се използва класически мембранно-електроден възел (MEA) и напрежение от 1,4–1,8 V за разделяне на водата на H₂ и O₂; газовете се отстраняват през различни канали.
- Издръжливост. Три устройства във физиологичен разтвор са работили 11 месеца, 2 години и 2,5 години на постоянен ток без разграждане от кислородния поток; след имплантиране при имунодефицитни и имунокомпетентни плъхове, производителността е била запазена.
Ограничения и „какво следва“
Това все още е предклинично: плъхове, висока плътност в капсулата, снабдяване с кислород - всичко е чудесно, но ключови тестове предстоят:
- мащабиране до човешки дози и времеви рамки;
- надеждност и захранване на електрохимици в човешкото тяло в продължение на години (архитектурата на захранването не е подробно описана в статията);
- минимизиране на фиброзата около капсулите и дифузионна стабилност;
- тестване върху бета стволови клетки и в модели, по-близки до човешките. Авторите открито сравняват своето решение с предишни подходи и го позиционират като платформа за клинично транслируеми капсули.
Заключение
За да могат трансплантираните бета-клетки да живеят и функционират без имуносупресори, те трябва да дишат. Екипът на Корнел и партньори показа, че мини-генератор на кислород, вграден в линейна капсула, може да „захранва“ клетките с O₂ достатъчно дълго и равномерно, за да издържат на висока плътност и да намалят захарта дори в подкожно място. Клиниката все още е далеч, но инженерната логика е проста и красива - да се даде на клетките въздух там, където липсва.
