Нови публикации
Учените са създали съединение "хамелеон" за лечение на резистентен на лекарства рак на мозъка
Последно прегледани: 02.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Ново проучване на учени от Йейлския университет описва как ново химично съединение атакува лекарствено-резистентни мозъчни тумори, без да уврежда здравата околна тъкан.
Проучването, публикувано в Journal of the American Chemical Society, е важна стъпка в разработването на така наречените „хамелеонови съединения“, които биха могли да се използват за борба с редица опасни видове рак.
Глиомите се развиват при приблизително 6,6 на 100 000 души всяка година и при 2,94 на 100 000 души до 14-годишна възраст. С изключение на метастазите от други видове рак, които достигат до централната нервна система, глиомите представляват 26% от всички мозъчни тумори (първични мозъчни тумори) и 81% от всички злокачествени мозъчни тумори.
В продължение на десетилетия пациентите с глиобластом са лекувани с лекарство, наречено темозоломид. Повечето пациенти обаче развиват резистентност към темозоломид в рамките на една година. Петгодишната преживяемост при пациенти с глиобластом е по-малка от 5%.
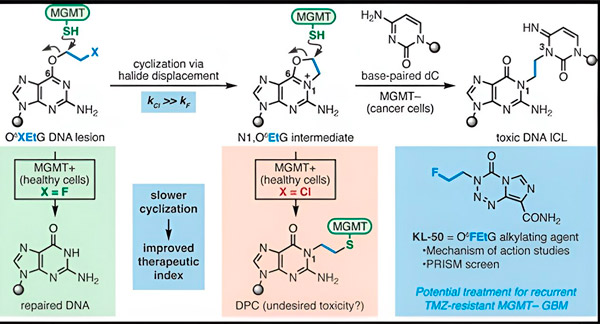
През 2022 г. химикът от Йейл Сет Херзон и радиационният онколог д-р Ранджит Биндра разработиха нова стратегия за по-ефективно лечение на глиобластоми. Те създадоха клас противоракови молекули, наречени хамелеонови съединения, които използват дефект в протеин за възстановяване на ДНК, известен като О6-метилгуанин ДНК метилтрансфераза (MGMT).
Много ракови клетки, включително глиобластомите, нямат протеина MGMT. Нови хамелеонови съединения са предназначени да увреждат ДНК в туморни клетки, на които липсва MGMT.
Хамелеоновите съединения инициират увреждане на ДНК, като отлагат първични лезии върху ДНК, които с течение на времето се развиват в силно токсични вторични лезии, известни като междуверижни кръстосани връзки. MGMT защитава ДНК на здравите тъкани, като поправя първичните лезии, преди те да могат да се развият в смъртоносни междуверижни кръстосани връзки.
За новото си проучване, съавторите Херзон и Биндра се фокусираха върху водещия си хамелеон, KL-50.
„Използвахме комбинация от изследвания в областта на синтетичната химия и молекулярната биология, за да изясним молекулярната основа на предишните ни наблюдения, както и химическата кинетика, която осигурява уникалната селективност на тези съединения“, каза Херзон, професор по химия „Милтън Харис“ в Йейл. „Показваме, че KL-50 е уникален с това, че образува ДНК кръстосани връзки само в тумори с дефектен ремонт на ДНК. Той щади здравите тъкани.“
Източник: Списание на Американското химическо дружество (2024). DOI: 10.1021/jacs.3c06483
Това е съществена разлика, посочват изследователите. Редица други противоракови съединения са разработени да задействат междуверижни кръстосани връзки, но те не са селективни за туморните клетки, което ограничава тяхната полезност.
Тайната на успеха на KL-50 е неговото време, отбелязват изследователите. KL-50 образува междуверижни кръстосани връзки по-бавно от другите омрежващи агенти. Това забавяне дава на здравите клетки достатъчно време да използват MGMT, за да предотвратят образуването на кръстосани връзки.
„Този уникален профил предполага потенциала му за лечение на лекарствено-резистентен глиобластом, област с голяма незадоволена нужда в клиниката“, каза Биндра, професор по терапевтична радиология „Харви и Кейт Кушинг“ в Медицинския факултет на Йейл. Биндра е и научен директор на Центъра за мозъчни тумори „Фамилия Ченевърт“ в болница „Смило“.
Херзон и Биндра заявиха, че тяхното проучване подчертава важността на отчитането на скоростта на химическа модификация на ДНК и биохимичен ремонт на ДНК. Те вярват, че могат да използват тази стратегия за разработване на лечения за други видове рак, които съдържат специфични туморно-асоциирани дефекти в ремонта на ДНК.
