Нови публикации
Системата за доставка на лекарства със затворен цикъл може да подобри доставката на химиотерапия
Последно прегледани: 02.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Когато пациенти с рак се подлагат на химиотерапия, дозите на повечето лекарства се изчисляват въз основа на телесната повърхност на пациента. Това се оценява с помощта на уравнение, което взема предвид височината и теглото на пациента. Това уравнение е формулирано през 1916 г. въз основа на данни само от девет пациенти.
Този опростен подход към дозирането не отчита други фактори и може да доведе до това, че на пациента ще бъде приложено твърде много или твърде малко лекарство. В резултат на това някои пациенти могат да изпитат ненужна токсичност или недостатъчна ефективност от химиотерапията, която получават.
За да подобрят точността на дозирането на химиотерапията, инженерите от MIT са разработили алтернативен подход, който позволява персонализиране на дозата за всеки пациент. Тяхната система измерва количеството лекарство в тялото на пациента и подава тези данни към контролер, който може да регулира скоростта на инфузия съответно.
Този подход би могъл да помогне за компенсиране на разликите във фармакокинетиката на лекарствата, причинени от телесния състав, генетичната предразположеност, индуцираната от химиотерапия органна токсичност, взаимодействията с други лекарства и храна, както и циркадните вариации в ензимите, отговорни за разграждането на химиотерапевтичните лекарства, казват изследователите.
„Като признаваме напредъка в разбирането за метаболизма на лекарствата и прилагаме инженерни инструменти за опростяване на персонализираното дозиране, ние вярваме, че можем да помогнем за трансформирането на безопасността и ефективността на много лекарства“, каза Джовани Траверсо, доцент по машиностроене в Масачузетския технологичен институт, гастроентеролог в болница „Бригам енд Уенс“ и старши автор на изследването.
Луис ДеРидър, докторант в Масачузетския технологичен институт, е водещ автор на статията, публикувана в списание Med.
Непрекъснато наблюдение
В това проучване изследователите се фокусират върху лекарство, наречено 5-флуороурацил, което се използва за лечение на колоректален рак и други видове рак. Лекарството обикновено се прилага в продължение на 46 часа, а дозата му се определя с помощта на формула, базирана на височината и теглото на пациента, което дава приблизителна оценка на телесната повърхност.
Този подход обаче не взема предвид разликите в телесния състав, които могат да повлияят на начина, по който лекарството се разпределя в тялото, нито генетичните вариации, които влияят на начина, по който се метаболизира. Тези разлики могат да доведат до вредни странични ефекти, ако се приложи твърде много от лекарството. Ако не се приложи достатъчно от лекарството, то може да не убие тумора, както се очаква.
„Хората с еднаква телесна повърхност могат да имат много различни височини и тегла, различна мускулна маса или различна генетика, но стига височината и теглото, включени в това уравнение, дават една и съща телесна повърхност, дозата им е идентична“, казва ДеРидър, докторант в програмата по медицинско инженерство и медицинска физика в програмата по здравни науки и технологии на Харвард-MIT.
Друг фактор, който може да промени количеството на лекарството в кръвта във всеки един момент, е циркадната вариация в ензим, наречен дихидропиримидин дехидрогеназа (DPD), който разгражда 5-флуороурацил. Експресията на DPD, подобно на много други ензими в тялото, се регулира от циркаден ритъм. По този начин, разграждането на 5-FU от DPD не е постоянно, а варира в зависимост от времето на деня. Тези циркадни ритми могат да доведат до десетократна вариация в количеството на 5-FU в кръвта на пациента по време на инфузия.
„Използвайки телесната повърхност за изчисляване на дозата на химиотерапията, знаем, че двама души могат да имат много различна токсичност от 5-флуороурацил. Един пациент може да има цикли на лечение с минимална токсичност, а след това цикъл с ужасна токсичност. Нещо се е променило в начина, по който пациентът е метаболизирал химиотерапията от един цикъл до следващия. Нашият остарял метод на дозиране не отчита тези промени и пациентите страдат в резултат на това“, казва Дъглас Рубинсън, клиничен онколог в Института за рак „Дана-Фарбър“ и автор на статията.
Един от начините за компенсиране на вариабилността във фармакокинетиката на химиотерапията е стратегия, наречена терапевтичен лекарствен мониторинг, при която пациентът дава кръвна проба в края на един лечебен цикъл. След като тази проба бъде анализирана за лекарствени концентрации, дозата може да бъде коригирана, ако е необходимо, в началото на следващия цикъл (обикновено две седмици за 5-флуороурацил).
Доказано е, че този подход води до по-добри резултати за пациентите, но не е широко използван за химиотерапии като 5-флуороурацил.
Изследователите от MIT искали да разработят подобен тип мониторинг, но по автоматизиран начин, който би позволил персонализиране на дозирането на лекарства в реално време, което би могло да доведе до по-добри резултати за пациентите.
В тяхната система със затворен контур, концентрациите на лекарствата могат да се наблюдават непрекъснато и тази информация се използва за автоматично регулиране на скоростта на инфузия на химиотерапевтичното лекарство, за да се поддържа дозата в целевия диапазон.
Тази система със затворен контур позволява персонализиране на дозирането на лекарствата, за да се вземат предвид циркадните ритми на нивата на ензимите, метаболизиращи лекарствата, както и всички промени във фармакокинетиката на пациента след последното лечение, като например индуцирана от химиотерапия органна токсичност.
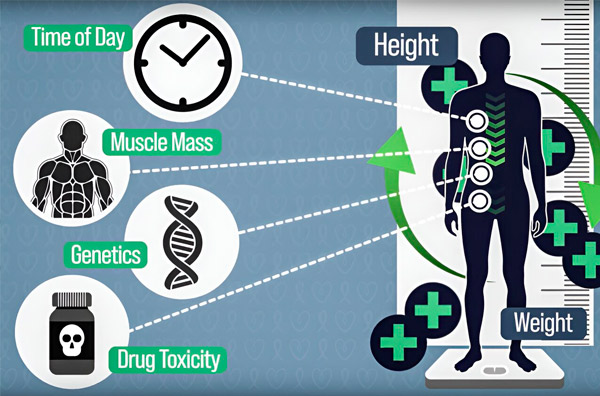
За да направят дозирането на химиотерапията по-прецизно, инженерите от MIT са разработили начин за непрекъснато измерване на количеството лекарство в тялото на пациента по време на многочасова инфузия. Това ще помогне за компенсиране на разликите, причинени от телесния състав, генетиката, лекарствената токсичност и циркадните колебания. Източник: С любезното съдействие на изследователите.
Новата система, разработена от изследователите, известна като CLAUDIA (Closed-Loop AUtomated Drug Infusion regulator - автоматизиран регулатор на инфузията на лекарства), използва налично в търговската мрежа оборудване за всяка стъпка. Кръвни проби се вземат на всеки пет минути и бързо се подготвят за анализ. Концентрацията на 5-флуороурацил в кръвта се измерва и сравнява с целевия диапазон.
Разликата между целевата и измерената концентрация се въвежда в контролен алгоритъм, който след това коригира скоростта на инфузия, ако е необходимо, за да поддържа дозата в диапазона от концентрации, при които лекарството е ефективно и нетоксично.
„Разработихме система, в която можем непрекъснато да измерваме концентрацията на лекарството и съответно да коригираме скоростта на инфузия, за да поддържаме концентрацията на лекарството в терапевтичния прозорец“, казва ДеРидър.
Бърза настройка
В тестове с животни, изследователите установили, че използвайки CLAUDIA, те могат да поддържат количеството лекарство, циркулиращо в тялото, в целевия диапазон около 45 процента от времето.
Нивата на лекарствата при животни, получаващи химиотерапия без CLAUDIA, остават в целевия диапазон средно само в 13% от случаите. Изследователите не са тествали ефективността на лекарствените нива в това проучване, но се смята, че поддържането на концентрации в целевия прозорец води до по-добри резултати и по-малка токсичност.
CLAUDIA също така успя да поддържа дозата на 5-флуороурацил в целевия диапазон, дори когато е прилагано лекарство, което инхибира ензима DPD. При животни, на които е даден този инхибитор без непрекъснато наблюдение и коригиране, нивата на 5-флуороурацил са се увеличили до осем пъти.
За тази демонстрация изследователите ръчно са извършили всяка стъпка от процеса, използвайки стандартно оборудване, но сега планират да автоматизират всяка стъпка, така че мониторингът и коригирането на дозата да могат да се извършват без човешка намеса.
За да измерят концентрациите на лекарства, изследователите са използвали високоефективна течна хроматография-масспектрометрия (HPLC-MS), техника, която може да бъде адаптирана за откриване на почти всеки вид лекарство.
„Виждаме бъдеще, в което можем да използваме CLAUDIA за всяко лекарство, което има подходящите фармакокинетични свойства и е откриваемо чрез HPLC-MS, което позволява персонализирано дозиране за много различни лекарства“, казва ДеРидър.
