Нови публикации
Серин срещу "диабетни" съдове в ретината: какво показа проучването
Последно прегледани: 09.08.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
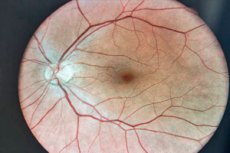
Статия, публикувана в списание Theranostics от група учени от Харвард/Детска болница в Бостън, установи, че добавките с обичайната аминокиселина серин значително потискат анормалната пролиферация на кръвоносни съдове в ретината (неоваскуларизация) в класически миши модел на хипоксична ретинопатия. Това „анормално“ съдово образувание е в основата на ретинопатията на недоносеността и пролиферативната диабетна ретинопатия, две водещи причини за загуба на зрение.
Идеята накратко
По време на хипоксия фоторецепторите изпитват енергиен глад и изпращат сигнал за „изграждане на повече съдове“ – това води до множество крехки, пропускливи капиляри. Авторите са тествали дали тази патологична реакция би била отслабена, ако ретината се захранва със серин (ключова аминокиселина в метаболизма на едновъглеродните групи и прекурсор на редица липиди). Отговорът е „да“ и доста убедително.
Какво точно направиха?
- Използван е модел на кислородно-индуцирана ретинопатия (OIR): новородените мишки са държани в 75% O₂ и след това са прехвърлени на въздух - това причинява „вълнообразна“ смърт и след това ретинална хипоксия с пик на неоваскуларизация на 17-ия ден от живота.
- Серинът е прилаган системно (интраперитонеално или перорално) по време на период на относителна хипоксия. Майките са поставени отделно на диета с ниско съдържание на серин/глицин, за да се види обратният ефект.
- Групите бяха сравнени по площ на неоваскуларизация и „безкръвни“ зони и беше извършен „мулти-омичен“ анализ на ретината: метаболомика, липидомика, протеомика, scRNA-секвениране. Плюс фармакология: те блокираха β-окислението на мастни киселини (етомоксир/малонил-CoA) и митохондриална АТФ синтаза (олигомицин), за да проверят чрез какво действа серинът.
Ключови резултати
- По-малко патологични съдове. Серинът значително намалява площта на неоваскуларизацията; докато дефицитът на серин/глицин в диетата на майките, напротив, я увеличава.
- Енергията е в центъра на историята. Ефектът на серина изчезва, когато окислението на мазнините (FAO) или окислителното фосфорилиране (OXPHOS) са инхибирани. Тоест, защитата зависи от митохондриите. В протеомиката се наблюдава увеличение на OXPHOS протеините; в транскриптомиката се наблюдава увеличение на „дихателните“ гени и намаляване на проангиогенните сигнали в клъстера на фоторецепторите на пръчиците.
- Липидни следи. Фосфатидилхолините, най-често срещаният клас мембранни фосфолипиди, се увеличават в ретината, което е логично за тъкани с колосален оборот на мембраните (фоторецептори).
- Кандидат-медиатор: HMGB1 е идентифициран като възможен нодален регулатор, чрез който серинът потиска проангиогенните сигнали по време на хипоксия.
Защо това е важно?
Днешните „тежки“ лечения – лазерни и анти-VEGF инжекции – запазват зрението, но имат ограничения и потенциални рискове, особено при кърмачета. Една проста хранителна стратегия, насочена към метаболизма на невроните в ретината, би могла да бъде нежно допълнение или „мост“ между леченията. Данните от наблюденията при хора са косвено последователни: ниският серин е свързан с макулна неоваскуларизация, а ремоделирането на серин/глициновия път е описано при ROP и диабетна ретинопатия. Тази работа добавя причинно-следствена връзка, макар и в модел.
Внимавайте: засега това са мишки
- OIR е модел, а не пълно копие на човешките заболявания; директно „пренасяне“ на дозите серин върху хората не може да се извърши.
- Системният прием на аминокиселини не е „безвреден витамин“: при някои състояния излишните аминокиселини/метаболитни промени могат да имат странични ефекти.
- Необходими са клинични проучвания: режими на безопасност, прозорци на ефикасност (при недоносени спрямо възрастни с диабетна ретинопатия), комбинация с анти-VEGF и въздействие върху изходното съдово ремоделиране.
Какво следва?
Логичните следващи стъпки са малки клинични пилотни проекти с биомаркери за митохондриална функция/липиден профил на ретината, тестване на серин в комбинация със съществуващи терапии и намиране на прецизни „молекулярни копчета“ (същият HMGB1) за целенасочена интервенция без системно зареждане с аминокиселини.
