Идентифициран е протеин, отговорен за генетично възпалително заболяване
Последно прегледани: 14.06.2024

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Екип от изследователи, ръководен от д-р Хироцугу Ода от CECAD Cluster of Excellence for Aging Research в Университета в Кьолн, откри ролята, която специфичен протеинов комплекс играе при някои форми на имунна дисрегулация. Този резултат може да доведе до разработването на нови терапевтични подходи, насочени към намаляване на автоинфлацията и „възстановяване“ на имунната система на пациенти, страдащи от генетична дисфункция на този протеинов комплекс.
Проучването „Биалелната човешка загуба на функция SHARPIN предизвиква автовъзпаление и имунодефицит“ е публикувано в Nature Immunology.
Линейният убиквитин-сглобяващ комплекс (LUBAC), съставен от протеините HOIP, HOIL-1 и SHARPIN, отдавна е признат за критичната си роля в поддържането на имунната хомеостаза. Предишни проучвания при мишки показаха тежки последици от загубата на SHARPIN, водещи до тежък дерматит поради прекомерна смърт на кожни клетки. Въпреки това, специфичните последици от дефицита на SHARPIN върху човешкото здраве досега остават неясни.
Изследователският екип докладва за първи път двама души с дефицит на SHARPIN, които проявяват симптоми на автоинфлация и имунодефицит, но неочаквано не проявяват дерматологични проблеми, както се наблюдава при мишки.
При по-нататъшно изследване беше установено, че тези индивиди имат нарушен каноничен NF-κB отговор, път, важен за имунния отговор. Те също така са имали повишена чувствителност към клетъчна смърт, причинена от членове на суперсемейството на фактора на туморната некроза (TNF). Лечението на един от пациентите с дефицит на SHARPIN с анти-TNF терапия, която специфично инхибира индуцираната от TNF клетъчна смърт, доведе до пълно разрешаване на автоинфлацията на клетъчно ниво и в клиничната изява.
Изследванията показват, че прекомерната и неконтролирана клетъчна смърт играе критична роля в човешките генетични възпалителни заболявания. Екипът на Oda добави дефицит на SHARPIN като нов член на група от генетични човешки възпалителни заболявания, които те предлагат да нарекат „вродени грешки на клетъчната смърт“.
Защита от имунна дисрегулация Изследването е започнато в лабораторията на д-р Дан Кастнер в Националния институт по здравеопазване (NIH) в Съединените щати. Учените там успяха да наблюдават един пациент с необясними епизоди на треска, артрит, колит и имунна недостатъчност в детска възраст.
След като получиха информирано съгласие, те извършиха секвениране на екзома на пациента и семейството му и откриха, че пациентът има разрушителен генетичен вариант в гена SHARPIN, водещ до неоткриваеми нива на протеин SHARPIN. Те също така установиха, че клетките на пациентите показват повишена склонност към смърт както в култивирани клетки, така и в биопсии на пациенти.
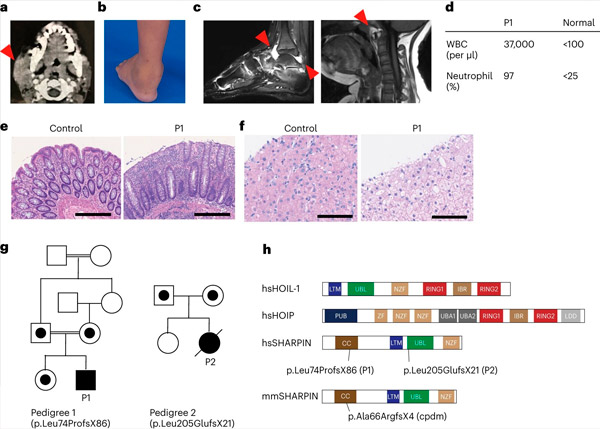
Дефицитът на SHARPIN при хората причинява автовъзпаление и чернодробна гликогеноза. Източник: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Екипът установи също, че развитието на лимфоидни зародишни центрове - специализирани микроструктури в аденоидите, които са критични за съзряването на В-клетките на нашата имунна система и следователно производството на антитела - е значително намалено поради увеличената смърт на В-клетките. Тези резултати обясняват имунодефицита при пациентите и подчертават важната роля на LUBAC за поддържане на имунната хомеостаза при хората.
„Нашето проучване подчертава критичното значение на LUBAC за защита срещу имунна дисрегулация. Чрез изясняване на молекулярните механизми, лежащи в основата на дефицита на LUBAC, ние проправяме пътя за нови терапевтични стратегии, насочени към възстановяване на имунната хомеостаза“, каза Ода, водещ автор на изследването.
Той добави: „Един от пациентите с дефицит на SHARPIN беше зависим от инвалидна количка в продължение на много години, преди да го видим за първи път. Глезените му бяха болезнени и беше твърде болезнено да ходи. Генетичната диагноза ни позволи да се насочим към правилния молекулярен път, който е в основата на неговите състояния."
Откакто пациентът започна да получава анти-TNF терапия, той е без симптоми почти седем години. „Като клиницист и учен, аз съм доволен, че имам възможността да повлияя положително на живота на един пациент чрез нашето изследване“, заключи Ода.
