Нови публикации
Лекарството LM11A-31 забавя прогресията на болестта на Алцхаймер при изпитване
Последно прегледани: 02.07.2025

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.

В скорошно проучване, публикувано в списанието Nature Medicine, учените проведоха рандомизирано, двойно-сляпо, плацебо-контролирано проучване фаза 2a, за да изследват безопасността и ефикасността на LM11A-31 при лечението на болестта на Алцхаймер (AD) чрез модулация на невротрофиновия рецептор p75 (p75NTR).
Къснопроявяващата се болест на Алцхаймер е най-често срещаната форма на деменция, характеризираща се със синаптична недостатъчност, дегенерация и загуба на нервни клетки. Въпреки че двете водещи лекарства за лечение на болестта на Алцхаймер са насочени към натрупването на анормални амилоид-β или тау протеини, те засягат само част от патофизиологията. Друг подход включва насочване към рецептори и сигнални мрежи, които влияят върху фундаментални биологични пътища. Предклиничните проучвания показват, че модулирането на p75NTR с нова малка химическа молекула, LM11A-31, намалява синаптичната загуба, причинена от амилоид и анормален тау.
Описание на изследването
В това рандомизирано клинично проучване, изследователите са изследвали дали LM11A-31 може да забави прогресията на болестта на Алцхаймер чрез модулиране на p75NTR при хора.
Участниците в проучването са получавали перорални капсули LM11A-31 в дози от 200 mg и 400 mg или плацебо в съотношение 1:1:1 на 242 пациенти с лека до умерена астма в продължение на 26 седмици. Участниците са имали биологично потвърдена болест на Алцхаймер (ниво на амилоидния β протеин 42 (Aβ42) в цереброспиналната течност под 550 ng/L или съотношение Aβ42:β40 под 0,89), диагностицирана съгласно критериите на McKhann, с резултати по Mini-Psychiatric Examination (MMSE) от 18 до 26, резултати по скалата за гериатрична депресия (GDS) под 5,0, резултати по модифицираната скала за исхемична болест на Хачински (HIS) ≤ 4,0, формално образование ≥ 8 години и предходен когнитивен спад ≥ 6 месеца.
Допустимите участници са приемали ацетилхолинестеразни инхибитори (AChEI) или частични NMDA рецепторни антагонисти в продължение на ≥ 3 месеца преди включване в проучването. Те не са приемали незаконни лекарства като антипсихотици, бензодиазепини, антиепилептични лекарства, успокоителни, централно активни антихипертензивни средства, ноотропици (с изключение на гинко билоба) или аналгетици, съдържащи опиоиди.
Основният резултат от проучването беше безопасността и поносимостта, оценени с помощта на скалата за оценка на тежестта на суицидни мисли и поведение на Колумбия (C-SSRS), жизнени показатели, кръвно налягане и хематологични параметри. За оценка на вторичните когнитивни резултати бяха използвани структурно-магнитно-резонансна томография (cMRI), флуородезоксиглюкозна позитронно-емисионна томография (FDG-PET) и биомаркери в цереброспиналната течност (CSF). Показателите за AD включваха Thr181-фосфорилиран тау, общ тау протеин, Aβ40, Aβ42 и AChE активност. Екипът използва персонализиран невропсихологичен тест за оценка на вторичните когнитивни резултати в изходно положение, на 12-та и 26-та седмица.
Резултати от изследването
Проучването установи, че LM11A-31 е безопасен и добре поносим, без значителни опасения за безопасността. Най-честите нежелани реакции включват главоболие, диария, еозинофилия и назофарингит, като стомашно-чревните проблеми и еозинофилията са водещите причини за прекратяване на приема. В групата с 400 mg е имало повече прекъсвания в сравнение с групите с 200 mg и плацебо. Ядрено-магнитният резонанс не е показал опасения за безопасността, включително аномалии, свързани с амилоид. Няма значителни разлики в когнитивните резултати или амилоидните аномалии между двете лекувани групи.
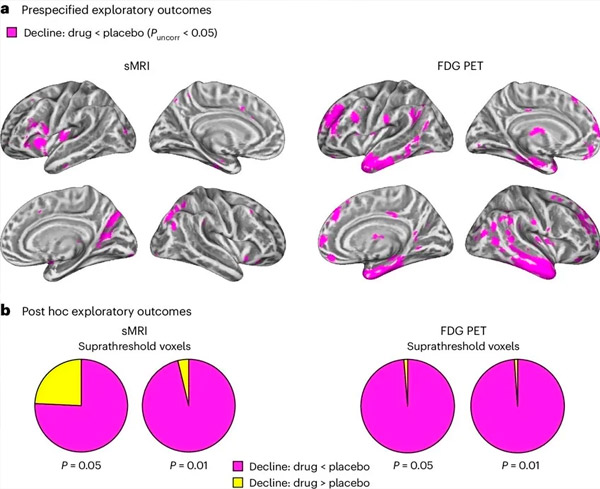
A. Двупосочен смесен моделен анализ на ковариацията изследва взаимодействията между лечението (лекарство или плацебо) и времето (преди или след лечението). Едностранен t-контраст, изследващ хипотезата за взаимодействие (лекарството забавя прогресията в сравнение с плацебо), показа, че лечението с LM11A-31 забавя надлъжната дегенерация (леви панели) и глюкозния хипометаболизъм (десни панели) в лекарствената група (cMRI, n = 127; PET, n = 121) в сравнение с плацебо групата (cMRI, n = 66; PET, n = 62). Вокселите, показващи това взаимодействие, са показани при некоригиран праг от P < 0,05 (магента) върху специфична за популацията кортикална повърхност. Лявото и дясното полукълбо са показани съответно в горния и долния ред. Мозъчни региони, показващи взаимодействия, несъвместими с хипотезата, са показани на Фигура 7 в допълнителните данни.
Б. Общ брой воксели в предварително дефинирани уязвими мозъчни области на болестта на Алцхаймер (обща площ на кръгови диаграми), показващи или взаимодействие в съответствие с хипотезата (магента), или взаимодействие, несъвместимо с хипотезата (жълто) във всяка образна модалност (cMRI, ляв панел; FDG PET, десен панел) при все по-либерални прагове на некоригирано P < 0,01 и P < 0,05. Симулациите от Монте Карло показаха, че съотношенията на вокселите, показващи ефекти в съответствие с хипотезата, спрямо несъвместимите с хипотезата, са значително по-високи от наблюдаваните въз основа на произволно генерирани данни както за cMRI, така и за PET (P < 0,001 за всяка модалност; двустранен тест).
LM11A-31 ефективно намалява увеличението на Aβ42 и Aβ40 в цереброспиналната течност в сравнение с плацебо групата. Лекарството също така показва намаление на средната годишна процентна промяна в пресинаптичния протеинов биомаркер SNAP25 и намаление на постсинаптичния биомаркер NG, което показва забавяне на загубата на пресинаптични и постсинаптични връзки. LM11A-31 също така намалява увеличението на YKL40, което води до намаляване на MMSE резултатите и увеличаване на ADAS-Cog-13 резултатите. Лекарството също така намалява загубата на сиво вещество във фронталния лоб и задната париетална кора и намаляване на глюкозния метаболизъм в области като енториналната кора, темпоралната кора, хипокампуса, инсуларната кора и префронталната кора.
Заключение
Проучването заключи, че модулирането на p75NTR от LM11A-31 е подходящо за по-големи клинични проучвания. LM11A-31 достигна първичната крайна точка за безопасност и се понесе добре от пациенти с лека до тежка болест на Алцхаймер. Резултатите показват необходимостта от по-нататъшни проучвания с по-дълга продължителност на лечението, за да се оцени потенциалът на малките молекули да регулират p75NTR като модифицираща заболяването терапия при болестта на Алцхаймер. Проучването показа, че LM11A-31 значително повлиява няколко биомаркера, включително Aβ40, Aβ42, SNAP25, NG и YKL40, което показва забавяне на патологичната прогресия. Бъдещи проучвания могат да оценят допълнителни показатели за здравето на глията.
